添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构


 美联医邦
美联医邦
文章类型: 血液淋巴癌症
2019年5月15日,美国FDA批准维奈克拉(商品名Venclexta)用于治疗成人慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)。
该项批准是基于CLL14 (NCT02242942)这一随机、多中心、开放标签对照试验,试验组采用维奈克拉与阿托珠单抗联用(VEN+G),对照组采用阿托珠单抗与苯丁酸氮芥联用。该试验总共纳入了432例有临床症状的先前未治疗过的CLL患者。
主要疗效结果是由独立审查委员会评估的无进展生存期(PFS)。该试验表明,与对照组患者相比,试验组患者PFS有统计学意义上的显著改善(p<0.0001)。中位随访28个月后,两组均未达到中位PFS。试验组总有效率为85%,对照组为71%,p = 0.0007。该试验还证实患者骨髓和外周血中微小残留疾病阴性率具有统计学意义的显著提高(每104个白细胞少于一个CLL细胞)。总生存期数据尚未完善。
在CLL/SLL患者中,维奈克拉与阿托珠单抗、利妥昔单抗联用,或维奈克拉单药使用时的最常见不良反应(≥20%)有中性粒细胞减少,血小板减少,贫血,腹泻,恶心,上呼吸道感染,咳嗽,肌肉骨骼疼痛,疲劳和水肿。
美国FDA曾给予维奈克拉优先审查资格,并授予“孤儿药”和“突破性疗法”称号。
请联系我们获取美国专家建议和美国药物专案申请
(1)10mg-50mg-100mg套装(数量42):2521美元/套
(2)10mg:28美元/2片,145美元/14片
(3)50mg:57美元/1片,348美元/7片
(4)100mg:106美元/1片,11650美元/120片,17471美元/180片
通用名:Venetoclax(维奈克拉)
商品名:Venclexta
生产厂家:AbbVie Inc. and Genentech Inc.
美国上市日期:2016-04-11
中国大陆未上市
Venclexta是一种BCL-2抑制剂:
(1)用于治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者。
(2)与阿扎胞苷或地西他滨或低剂量阿糖胞苷联用,治疗新诊断的年龄≥75岁或因合并症不能使用强化诱导化疗的急性粒细胞白血病(AML)成人患者。
(1)
① 治疗CLL/SLL递增剂量:
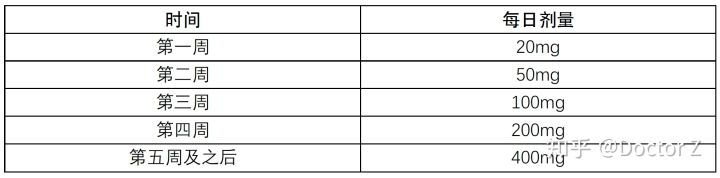
维奈克拉与阿托珠单抗联用:
阿托珠单抗于第一周期第1天给予100mg,第一周期第2天给予900mg,第一周期第8天和第15天给予1000mg,此后每个28天为一周期的第一天给予1000mg。总共给予6个周期。第一周期第22天开始根据5周递增剂量表给予维奈克拉。在第二周期第28天完成5周递增剂量后,患者应从第三周期第1天持续使用维奈克拉400/日,直至第十二周期的最后一天。
维奈克拉与利妥昔单抗联用:
患者完成5周递增剂量后且服用400mg/日维奈克拉7天后开始给予利妥昔单抗。在每个28天为一周期的第一天给予利妥昔单抗,给药6个周期,第一周期给予利妥昔单抗375mg/㎡,第二至六周期给予500mg/㎡。患者应从利妥昔单抗第一周期第1天开始持续服用维奈克拉400mg/日,服用24个月。
维奈克拉单药使用:
患者完成5周递增剂量后的推荐剂量为400mg/日,直至疾病进展或发生不可耐受的毒性。
② 治疗AML剂量:
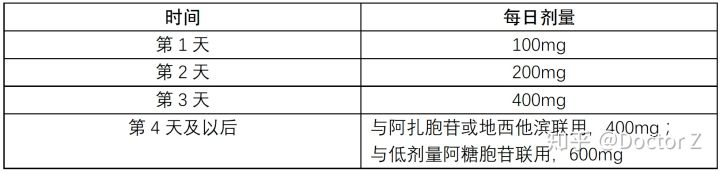
从第1天就开始联用阿扎胞苷或地西他滨或低剂量阿糖胞苷,持续使用维奈克拉直至疾病进展或出现不可耐受的毒性。
(2)VENCLEXTA片应每日一次与食物和水同服。不要咀嚼、压碎或破坏药片。
(3)预防肿瘤溶解综合征(TLS)。在第一次给予维奈克拉前对患者进行预处理以减少TLS风险。
① CLL/SLL患者预处理:
维奈克拉可致肿瘤细胞迅速减少,因此在起初的5周递增剂量期间有导致TLS的风险。需适当治疗的与TLS一致的血生化指标的改变,可在首剂给药和每次剂量递增时最早6-8小时出现。
TLS的风险基于多种因素,包括肿瘤负荷和合并症。肾功能降低(肌酐清除率<80 mL/min)进一步增加了风险。对所有患者进行肿瘤负荷评估包括影像学评估(如CT扫描)和血生化评估(钾,尿酸,磷,钙和肌酐),并在开始用维奈克拉治疗之前纠正先前存在的异常。随着肿瘤负荷的减少,风险可能会降低。
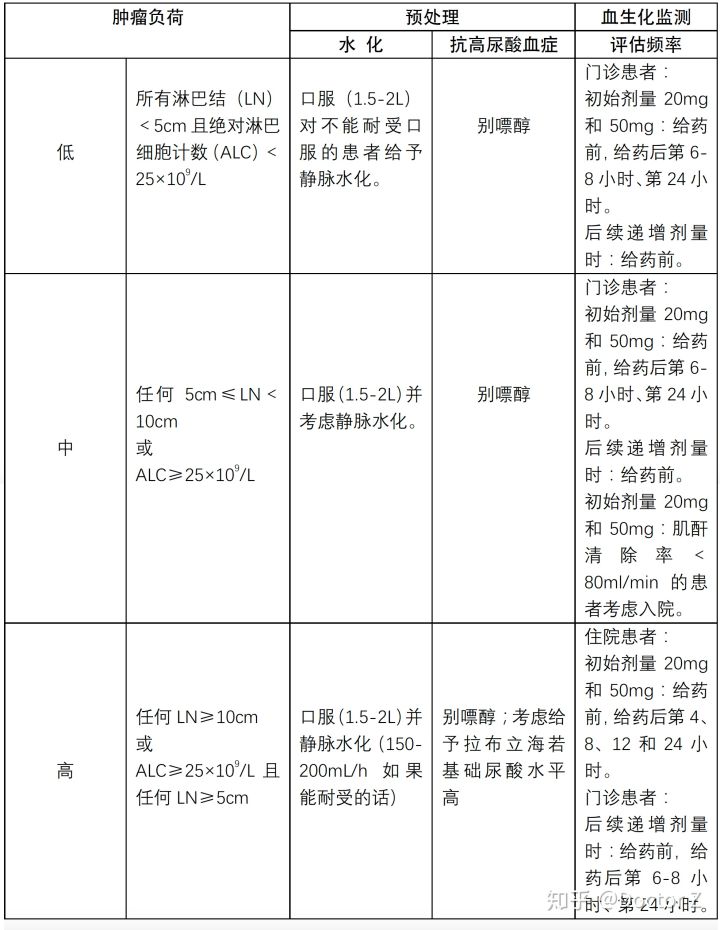
注: ①在给予维奈克拉前2-3天开始给予别嘌醇或黄嘌呤氧化酶抑制剂。
②评估血生化(钾、尿酸、磷、钙和肌酐),及时查看报告。
② AML患者预处理:
在启用维奈克拉之前,所有患者白细胞计数应<25×109/L。可能需要在治疗前采取细胞减瘤治疗。
在第一次给药前,给予所有患者预处理,包括充足的水化和抗高尿酸血症药物,并在后续剂量递增时继续预处理。
在启用维奈克拉之前,评估血生化(钾、尿酸、磷、钙和肌酐)并纠正之前存在的异常。
每次剂量递增时,在给药前、给药后6-8小时监测血生化,在达到最终剂量后24小时监测血生化。
对于有TLS风险的患者(例如循环原始细胞、高负荷白血病累及骨髓、治疗前乳酸脱氢酶升高,或肾功降低),应考虑额外的措施,包括加强实验室监测和减少维奈克拉起始剂量。
片剂,10mg,50mg,100mg
禁忌在初始用药期间和剂量递增期间与强CYP3A抑制剂联用。
(1)肿瘤溶解综合征(TLS):预处理TLS;评估所有患者的风险。给予抗高尿酸血症预处理并充分水化。随着总的风险增加,采取更加密集的措施(静脉补液,频繁监测,住院治疗)。
(2)中性粒细胞减少症:监测血细胞计数和感染体征。给予适当治疗。
(3)感染:监测感染的症状和体征,并适当治疗。对感染≥3级的患者暂停给药直至感染治愈。
(4)免疫接种:在维奈克拉治疗之前、治疗期间或治疗后不要给予减毒活疫苗。
(5)胚胎-胎儿毒性:可能导致胎儿伤害。告知育龄期女性可能对胎儿的潜在伤害,并在治疗期间使用有效的避孕措施。
(1)在CLL/SLL患者中,维奈克拉与阿托珠单抗或利妥昔单抗联用时或单药使用时的最常见不良反应(≥20%)有中性粒细胞减少,血小板减少,贫血,腹泻,恶心,上呼吸道感染,咳嗽,肌肉骨骼疼痛,疲劳和水肿。
(2)在AML患者中,与阿扎胞苷或地西他滨或低剂量阿糖胞苷联用时的最常见不良反应(≥30%)有恶心,腹泻,血小板减少,便秘,中性粒细胞减少,发热性中性粒细胞减少,疲劳,呕吐,外周水肿,发热,肺炎,呼吸困难,出血,贫血,皮疹,腹痛,败血症,背痛,肌痛,头晕,咳嗽,口咽疼痛,以及低血压。
哺乳:不建议哺乳。
相关阅读
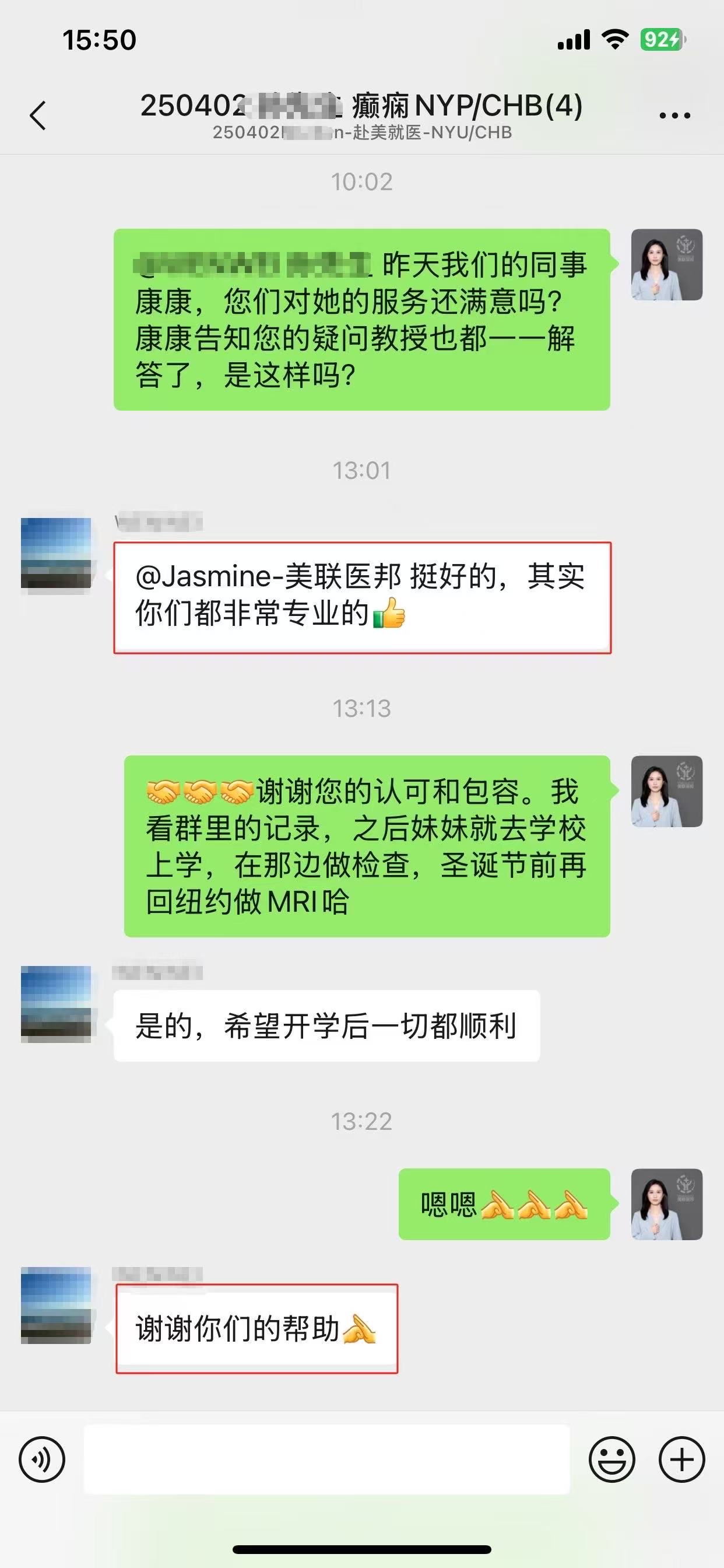
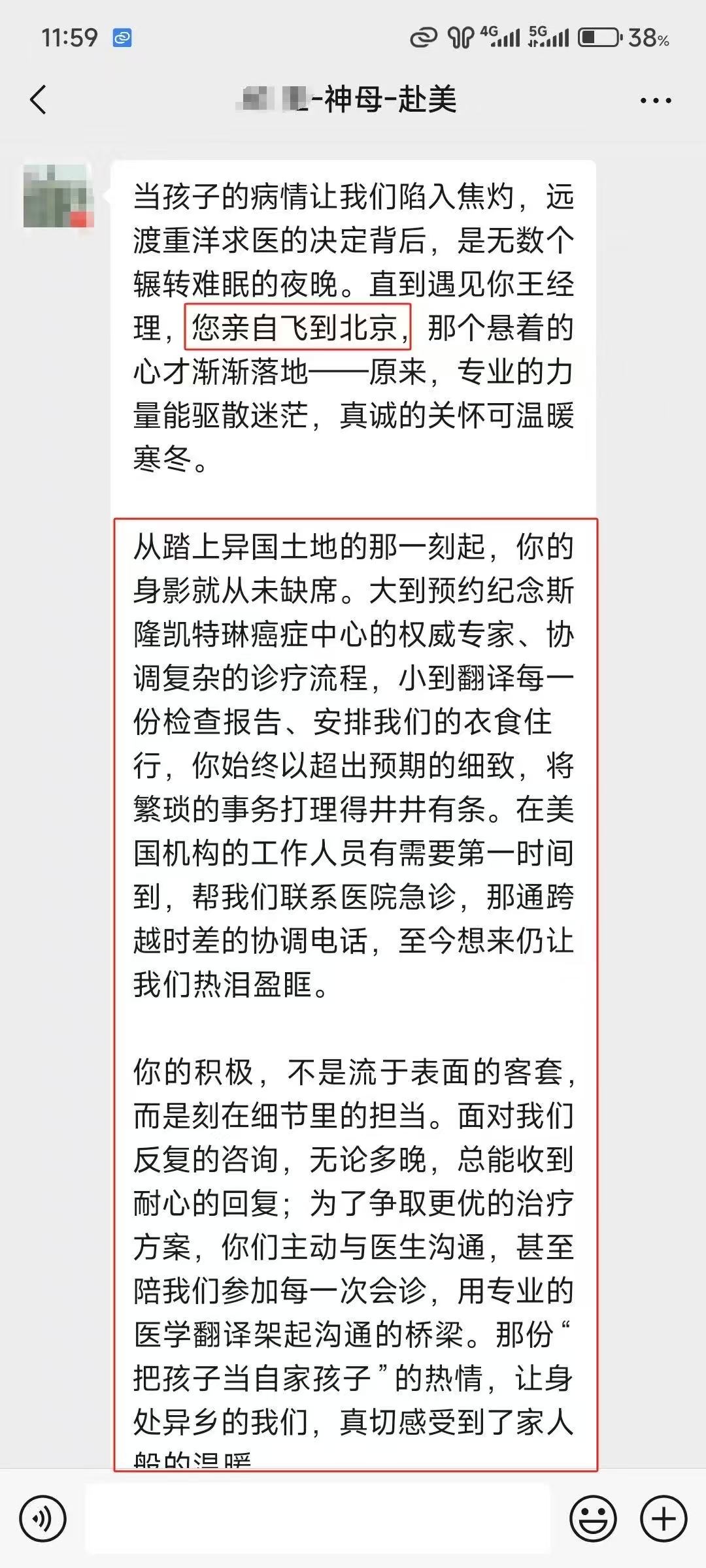
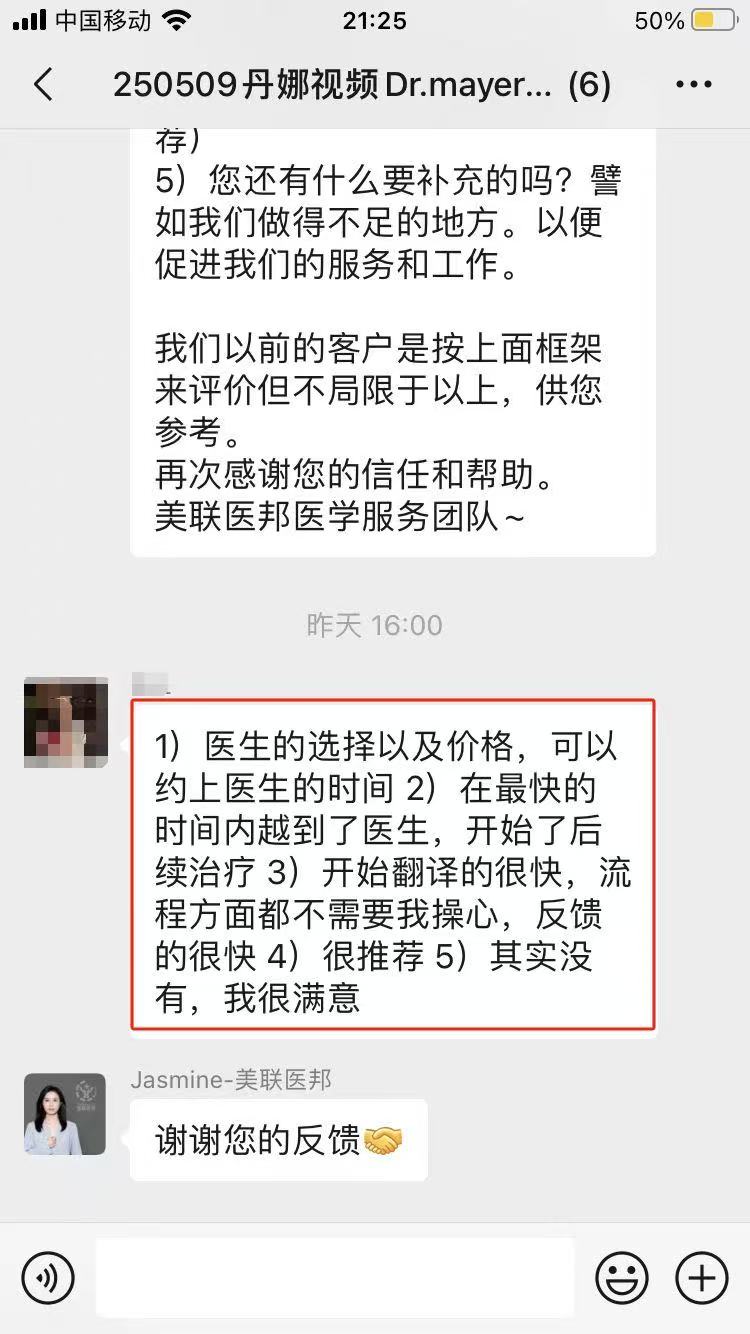
美联医邦美国名医真实案例
☞中国还原体肌病患儿获美国专家免费5+小时多学科会诊、免费食宿,感恩遇见美国最高政府卫生研究院
☞膀胱癌患者通过视频会诊中美两国三地联线哈佛名医,寻求治疗方案及临床试验建议
![]()
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
本文由美国美联医邦Medebound编辑原创,未经美联医邦允许,不得转载,违者必究。美国美联医邦借助其30年历史的美国顶级名医网络,用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询,出国就医和新药绿通,为生命续航。客服微信:“mede1917", 全国电话:4006162591,微信公众号:“美联医邦”。

凭借我们30多年的美国医疗网络资源,您可以直接与美国医疗精英对话,在家中咨询美国顶级专家或国际会诊,不出国门获取先进治疗方案。
凭借我们30年的医疗网络资源,您可以直接与美国医疗精英对话。在家中咨询疑难疾病的专家,轻松了解治疗方案。
如需赴美就医或获取海外新药,我们为您一站式安排海外看病等服务。



服务优势
预约知名美国专家譬如安德森癌症医院和梅奥诊所,安排无忧出国看病行程,寻找全球新药新技术医生网络
我们与美国顶级1%的海外医疗医生网络,300+所美国权威医院和药房资源深度合作一站式海外诊疗我们的专属客服医学经理,为您免费咨询,最短时间获取预约优质医疗资源

Jason 王经理
医学客服经理/添加微信:Mede2018

Kiki 圆经理
医学客服经理/添加微信:mede1917

如果您和您的家人有任何医疗和新药需求,请欢迎随时联系我们。我们客服团队工作时间周一到周五早上9点到晚上8点,北京时间。
总部位于纽约,9年专注美国,是赴美就医服务细分领域的头部机构。 始终坚持精英式定制(非保姆式),获30+历史卡思克鲁力医生集团(全美TOP医生联盟)及股东战略产业投资,不涉及风险资本。 作为美国本土医疗资源提供商,美联医邦已与中国平安、泰康人寿、太平人寿等保险集团达成总对总合作。服务覆盖数百万保险客户。美国福布斯榜推荐和英文报道,直通全美前5%顶级专家网络。只精准对接全美72个专科排名TOP3医院,包括梅奥诊所、MD安德森、纪念斯隆-凯特琳癌症中心等百余家美国著名医疗机构。申请美国医院的折扣率10-30%,和美国医院议价能力高。3000+客户的信任选择,一切从用户角度出发,鼓励部分患者远程二诊/问诊拿方案在国内治疗,不过度宣传和劝退不必要的赴美看病。
了解更多美国美联医邦成都运营服务中心
Disclaimer 免责声明:
本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound北京国际会诊中心:
北京市东城区天坛南里12号医疗机构
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com