添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
感恩9年信任,作为美国本土海外医疗机构,我们服务了数千亚洲家庭,连线72专科全美Top1%医院医生网络。
为什么我们值得选择
WHY YOU SHOULD CHOOSE MEDEBOUND

我们能对接到很难约到的Top美国名医
1000+ US Physician Network
不论是去美国看病还是美国专家远程会诊,对接到海外著名医院里面的TOP权威医生是其中至关重要的一步。卡思克鲁力是美国Top医生的最高奖项之一,联合创始人卡思先生和克鲁力博士是美联医邦的投资股东。 不同于其他中间商,我们覆盖美国上千家医院,72个专科的前1%和前5%的顶级医生的直通资源。

中国保险500强信任背书
Endorsed by Largest Insurers
作为美国本土医疗资源的机构,且接受美国Forbe报道,至今美联医邦 Medebound HEALTH 已经在总对总层面,签约中国保险集团包括中国平安,泰康人寿,太平人寿等,服务覆盖数百万保险人群提供海外第二诊疗意见,出国看病和海外就医等海外看病医疗服务。

只为了帮您寻求希望,9年我们只专注一件事
We Only Focus on One Thing
因专注而专业,WE TRULY CARE. 我们始于海外二诊和远程医疗,但不止于此。我们不遗余力为您找到海外最佳治疗手段。这包括了专注落地解决方案, 协助方案在国内落地包括海外新药申请以及赴美看病。
美国新药案例
Our cases

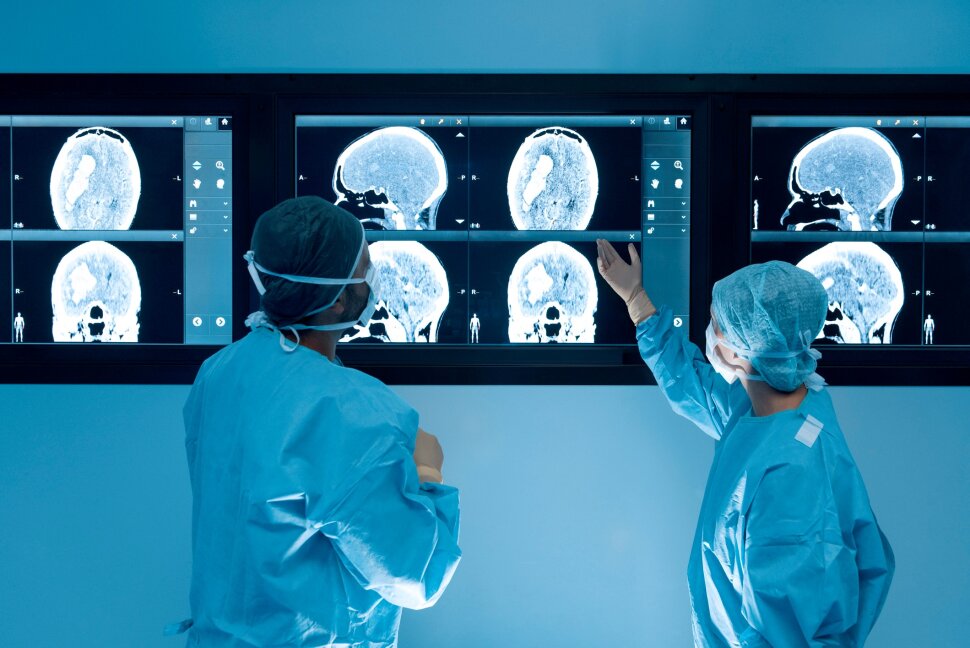


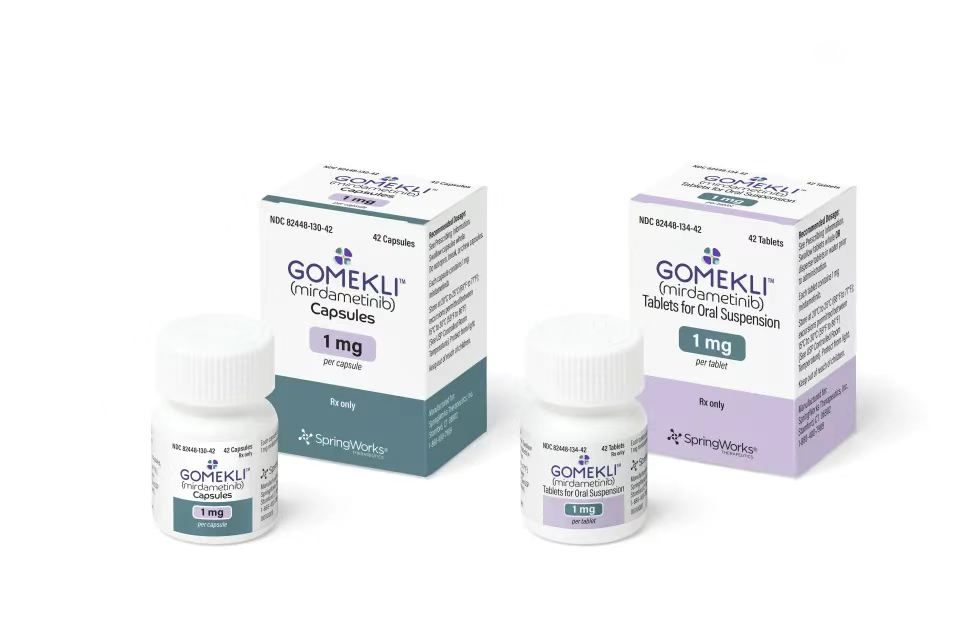
在各个疾病领域,在数千例海外看病,出国就医,视频二诊,和美国海外医疗案例中,我们收到了大量的好评。
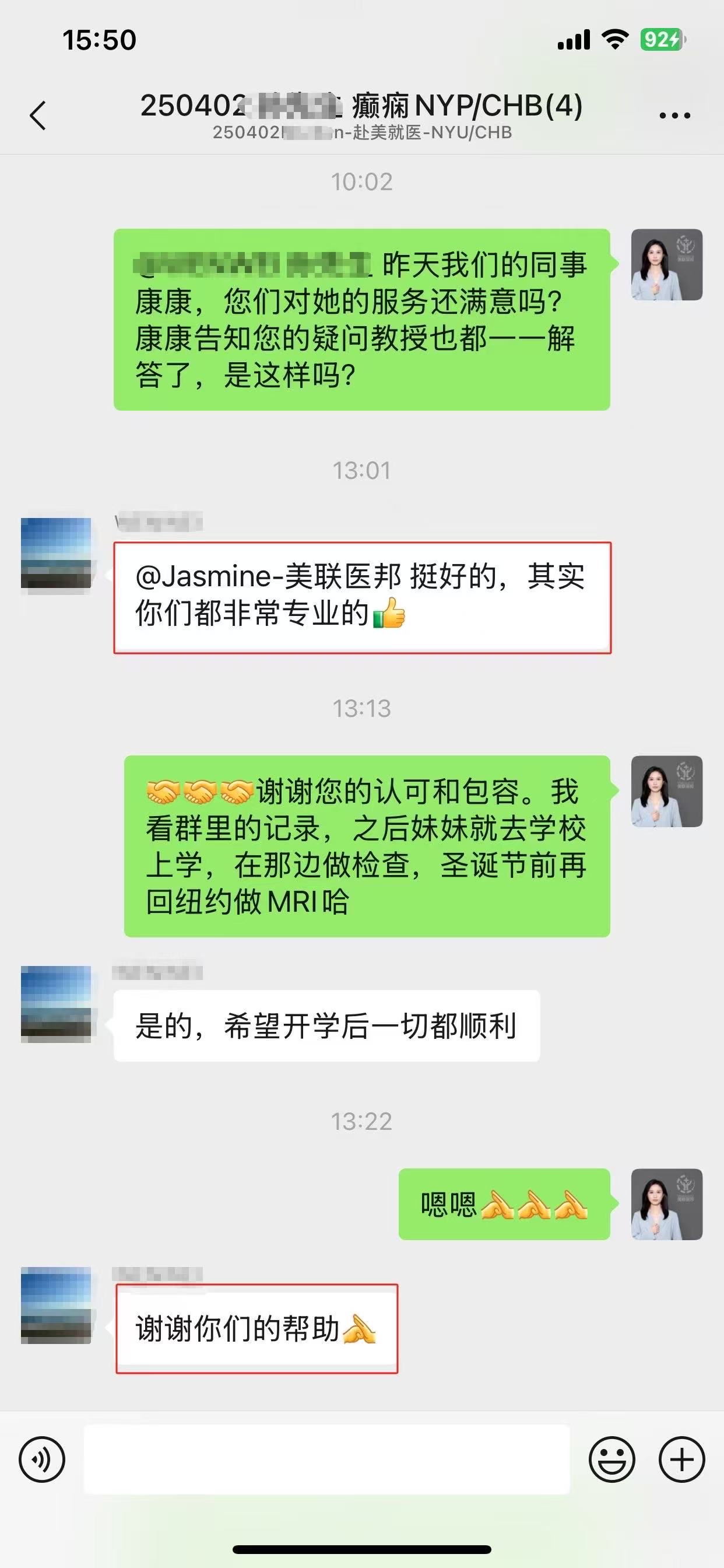
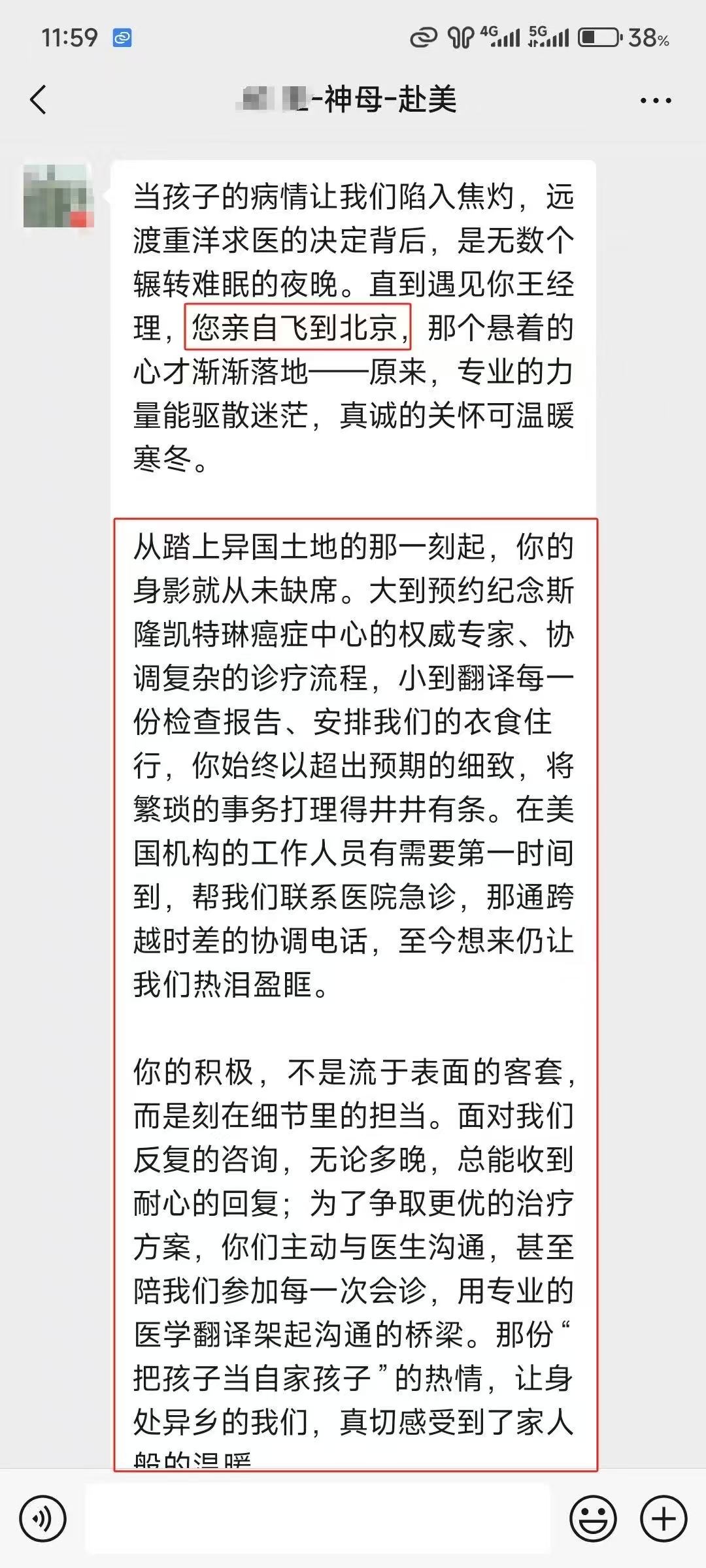

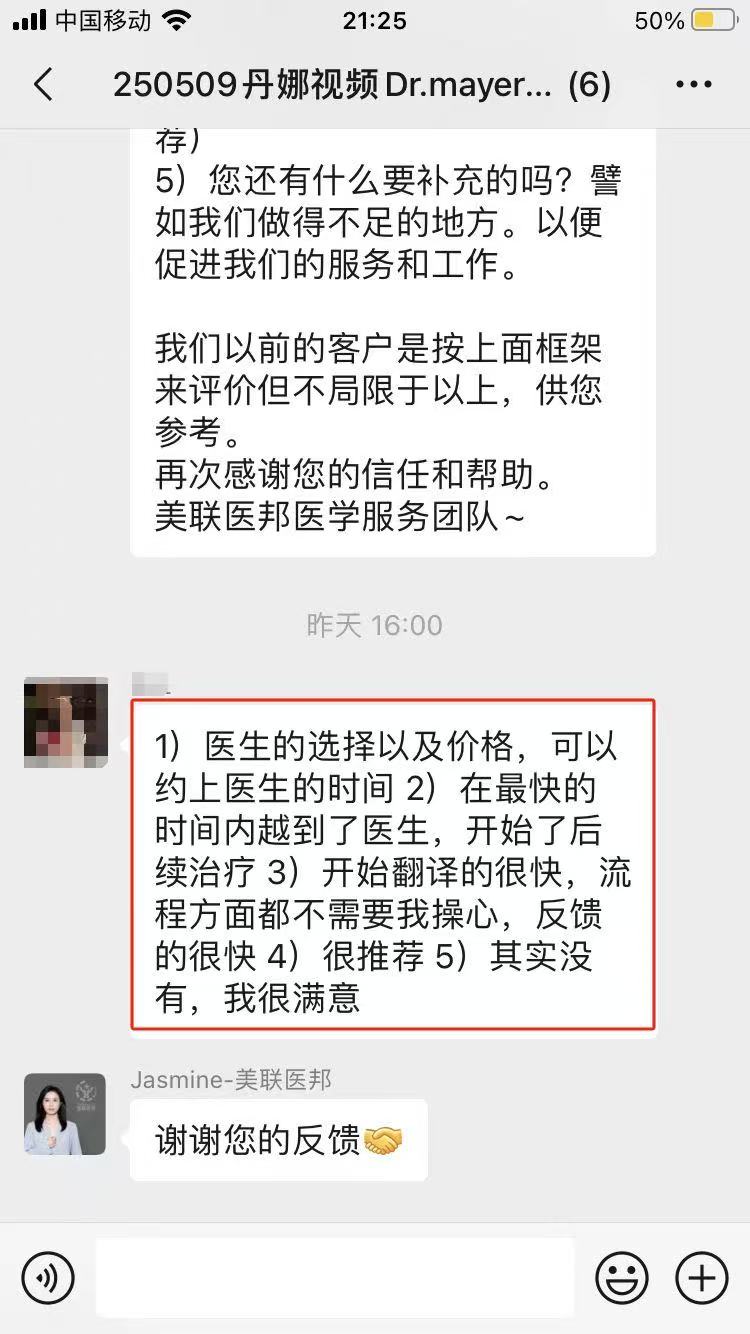
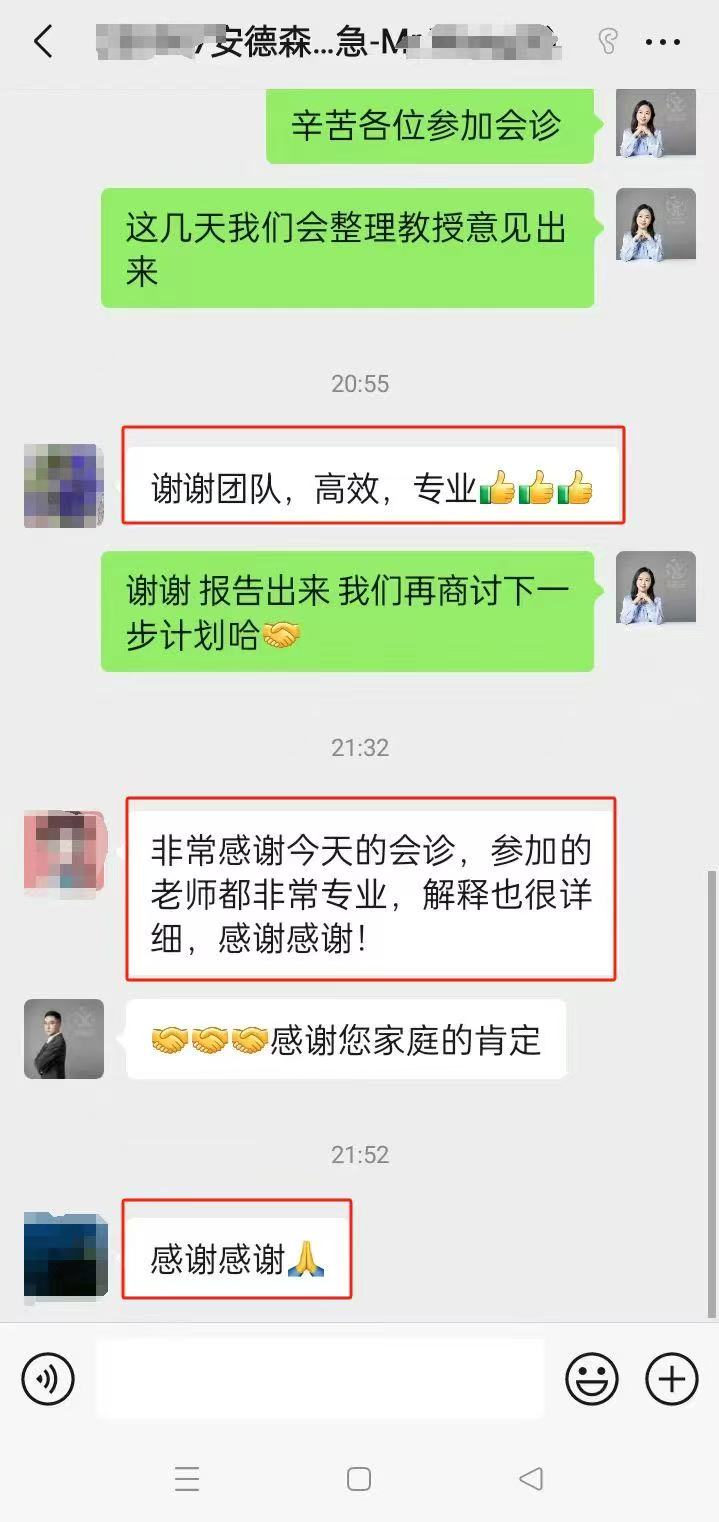
赴美就医还是远程医疗,我们一切会以患者为中心,请联系我们
纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound北京国际会诊中心:
北京市东城区天坛南里12号医疗机构
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com