美国持续的创新成果不断给世人希望,赴美就医服务机构了解到这也是许多人寻求出国看病的原因。美联医邦拥有9年看病服务经验,将为大家分享:肺癌新药抗PD-L1单抗度伐鲁单抗durvalumab已经获批用于接受了同步放化疗后未进展的局部晚期非小细胞肺癌NSCLC的维持治疗。近日,度伐鲁单抗durvalumab用于晚期非小细胞肺癌NSCLC三线或以上治疗的II期临床试验ATLANTIC研究结果在《Lancet Oncology》杂志发表。
一、背景
过去15年,晚期NSCLC的治疗经历了重大变革。对于EGFR突变和ALK重排的患者,靶向治疗改变了以往传统的治疗模式。对于EGFR/ALK野生型的患者,化疗一度是主要的治疗方案,但疗效一般。然而,在过去3年,免疫检查点抑制剂成为晚期NSCLC另一重要治疗手段。但对于二线治疗失败后的患者,三线治疗仍然缺乏标准治疗方案。临床实践中,吉西他滨或长春瑞滨是常见的三线治疗选择,因为这两个化疗药物的安全性尚可以接受,但获益不明。
PD-1/PD-L1通路在调控T细胞活化中扮演着重要角色。目前,抗PD-1单抗nivolumab,Pembrolizumab和抗PD-L1单抗atezolizumab已经获得欧盟和美国FDA批准用于晚期非小细胞肺癌NSCLC。来自多个研究对汇总数据提示,PD-L1高表达的晚期非小细胞肺癌NSCLC患者,接受免疫检查点抑制剂治疗的疗效优于PD-L1低表达人群。此外,回顾性分析提示,EGFR/ALK阳性的患者疗效差于EGFR/ALK阴性的患者。
度伐鲁单抗durvalumab是一个选择性的,赴美就医服务机构了解到高亲和力的抗PD-L1的Ig G1单抗,目前已经获得美国FDA批准用于铂类耐药的局部晚期或转移性尿路上皮癌和同步放化疗结束后未进展的局部晚期NSCLC的维持治疗。既往,在包括多个瘤种的I-II期研究者,度伐鲁单抗durvalumab显示出令人鼓舞的疗效。相比于PD-L1表达<25%的患者,PD-L1表达>=25%的患者,接受度伐鲁单抗durvalumab治疗的ORR更高,且OS更长。II期ATLANTIC研究直至评估度伐鲁单抗durvalumab用于晚期非小细胞肺癌NSCLC三线或以上治疗的疗效和安全性,这一研究根据患者EGFR/ALK突变状态和PD-L1表达水平分为3个独立的研究队列。
二、方法
ATLANTIC研究是一项开发的单臂II期研究,赴美就医服务机构了解到入组年龄18岁以上, IIIB/IV期非小细胞肺癌NSCLC,患者有可测量病灶,预计生存期至少为12周,WHO PS评分0-1分。患者既往接受过至少二线治疗,其中一线治疗为铂类为基础的化疗。出国看病服务机构了解EGFR突变和ALK阳性的患者需接受过至少一线EGFR-TKI或ALK-TKI治疗。
患者的EGFR和ALK突变状态根据当地检测报道。研究最初入组时不要求患者PD-L1表达状态,后续修改研究方案,仅入组PD-L1表达>=25%(肿瘤细胞膜染色)的患者。选择25%作为cut-off值是基于既往的一项1-2期研究结果:相比于PD-L1表达<25%的患者,PD-L1表达>=25%的患者,接受度伐鲁单抗durvalumab治疗的ORR更高。为进一步评估PD-L1更高表达是否可以进一步提高疗效,研究增加了第3个队列,入组EGFR/ALK阴性,且PD-L1表达>=90%的患者。选择90%作为cut-off值是基于既往的一项1-2期研究结果:PD-L1表达>=90%的患者出现疗效反应的可能性更大(7/18,39%)。
研究共分为3个队列:队列1,EGFR+/ALK+ NSCLC,且PD-L1表达>=25%;队列2,EGFR-/ALK-且PD-L1表达>=25%或<25%;队列3,EGFR-/ALK-且PD-L1表达>=90%. 患者接受度伐鲁单抗durvalumab 10mg/kg,q2w直至确认的疾病进展或不可耐受的毒性,至多治疗12个月。出国看病服务机构了解主要研究终点为ORR,采用RECIST 1.1标准评价。次要终点包括OS,PFS,DoR,DCR(CR+PR+SD>=6个月),至疾病缓解时间。
三、结果
结果2014年2月25日至2015年12月28日,研究共入组444例患者:队列1(EGFR+/ALK+)111例;队列2(EGFR-/ALK-)265例;队列3(EGFR-/ALK-;PD-L1>=90%)68例。患者既往至少接受过2线治疗,最多的患者既往接受过11线治疗。研究入组流程图见下图1.
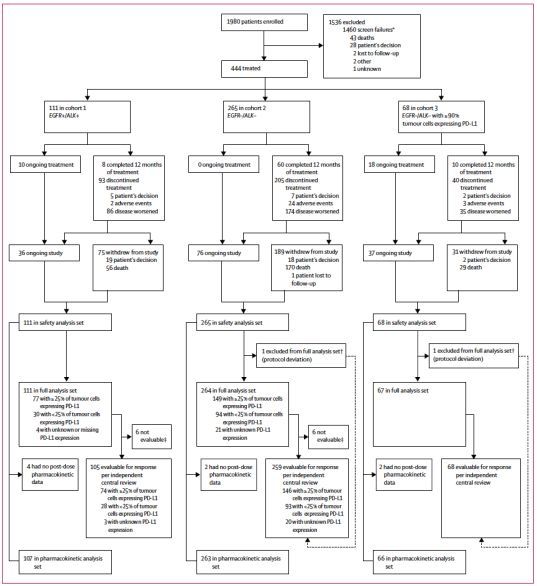
图1. 研究入组流程图
截至2016年6月3日,队列1,2,3的中位随访时间为6.7个月,9.2个月和7.0个月;接受度伐鲁单抗durvalumab治疗的中位治疗周期数分别为6个,8个和12.5个。患者在未达到12个月之前停药的主要原因为疾病进展。在停止度伐鲁单抗durvalumab治疗后,444例患者中100例接受了后续的系统性抗肿瘤治疗,最常见的治疗方案为厄洛替尼(22例),3例患者接受了后续的免疫检查点抑制剂治疗(均为nivolumab)。
队列1中,77例患者肿瘤PD-L1表达>=25%,其中74例可以进行疗效评价;30例患者肿瘤PD-L1表达<25%,其中28例可以进行疗效评价;其余4例患者PD-L1表达状态未知,其中3例可进行疗效评价。在队列2中,149例患者肿瘤PD-L1表达>=25%,其中146例可以进行疗效评价;95例患者肿瘤PD-L1表达<25%,其中93例可以进行疗效评价;其余21例患者PD-L1表达状态未知,其中20例可进行疗效评价。队列3中的68例患者均可以进行疗效评价,其中只有1例患者的PD-L1表达<90%(PD-L1表达为70%)。
在队列1中,74例EGFR+/ALK+,且PD-L1>=25%的患者,9例(12.2%)取得客观缓解。队列2中,146例EGFR-/ALK-,且PD-L1>=25%的患者,24例(16.4%)取得客观缓解。队列3中,68例EGFR-/ALK-,且PD-L1>=90%的患者,21例(30.9%)取得客观缓解。无论患者的EGFR/ALK突变状态,PD-L1高表达的患者相比于低表达患者ORR更高。在队列2的146例PD-L1>=25%的患者中,70例患者的PD-L1表达>=90%,这些患者的ORR为15.7%(11/70)。汇总队列2和3,共138例患者PD-L1表达>=90%,ORR为23.2%(32/138)。疗效总结见下表2. 患者第一次用药至出现疗效的中位时间位1.8至2.1个月。在所有队列中,无论患者的PD-L1表达水平,疗效持续时间都很持久。6个月的疾病控制率,EGFR-/ALK-患者较EGFR+/ALK+患者高;PD-L1高表达的患者较PD-L1低表达或不表达的患者高,见下表2.
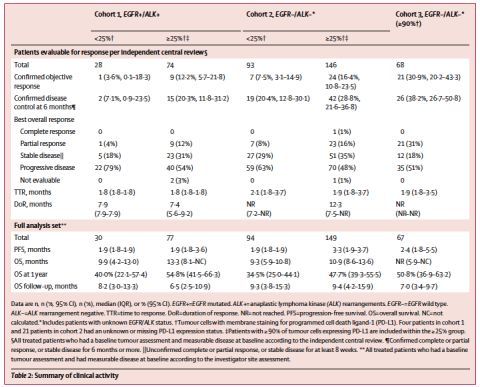
表2
至最后随访日期,队列1中PD-L1表达>=25%的77例患者,63例(82%)出现疾病进展或死亡。队列2中PD-L1表达>=25%的149例患者,124例(83%)出现疾病进展或死亡。队列3的67例患者中,46例(69%)出现疾病进展或死亡。在EGFR-/ALK-的患者中(队列2和3), PD-L1高表达(>=25%或>=90%)患者的中位PFS长于PD-L1低表达或不表达的患者;但在EGFR+/ALK+的患者中(队列1),没有观察到这一现象。3个队列患者的中位PFS对比见下图。
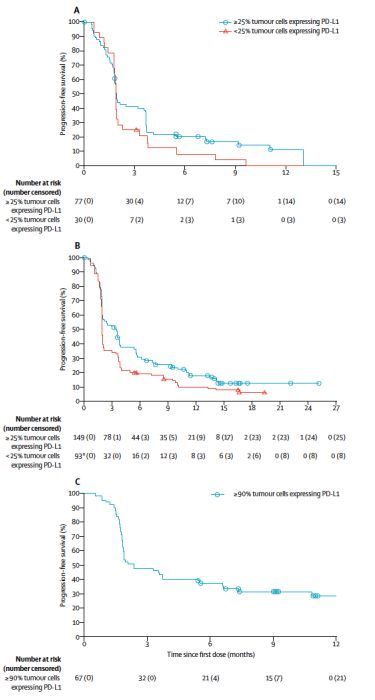
图2. 患者的PFS对比
至最后随访日期,队列1,队列2和队列3的PD-L1高表达人群中(PD-L1>=25%或>=90%),分别有32例(42%),91例(61%)和30例(45%)患者死亡。无论患者EGFR/ALK状态,PD-L1高表达(>=25%或>=90%)患者的中位OS长于PD-L1低表达或不表达的患者,见下图3;其中队列3中患者的中位OS尚未达到。
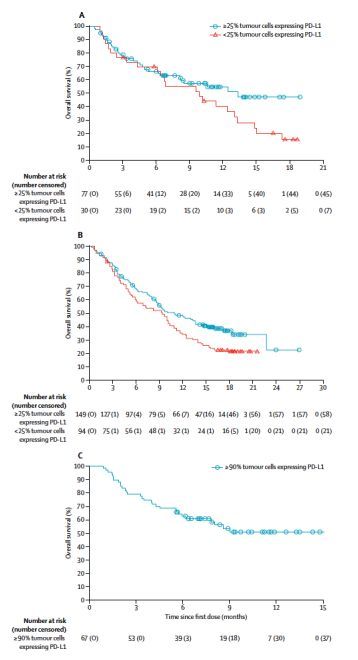
图3. 患者的OS对比
四、结论和讨论
ARLANTIC研究的结果显示,抗PD-L1单抗度伐鲁单抗durvalumab用于既往经过多线治疗后的晚期非小细胞肺癌NSCLC患者,有较好的临床疗效,且耐受性好。且无论患者的EGFR/ALK突变状态和PD-L1表达水平,均观察到了持久的疗效和鼓舞人心的OS结果。这一研究肯定了既往1-2期研究的结果,度伐鲁单抗durvalumab于其他抗PD-1/PD-L1单抗用于晚期非小细胞肺癌NSCLC后线治疗的疗效和安全性一致。这一II期研究结果提示,虽然PD-L1高表达患者的ORR更高,但取得疗效的患者中,无论其PD-L1表达水平,疗效均较持久。值得一提的是,这一研究入组了EGFR突变的患者,后续需要进一步探索EGFR突变伴PD-L1高表达这类人群,是否可以从免疫治疗中获益。
参考文献
Durvalumab as third-line or later treatment for advanced non-small-cell lung cancer (ATLANTIC): an open-label, single-arm, phase 2 study. Lancet Oncol 2018
Published Online March 12, 2018
http://dx.doi.org/10.1016/S1470-2045(18)30144-X
美联医邦8年来服务了上千例海外就医的客户,希望以上的分享能够帮助到您,如果您想要寻求帮助,请拨打国内电话热线400-6162591,来电时请提及文章专属码2021以享受独家折扣,或添加客户经理Emma微信mede_2021立即获取更多信息。
▌ 我们可以提供
▪ 收集病史资料,赴美就医服务机构了解到撰写国际转诊病历报告;
▪ 准确选择美国对口医院,快速预约美国专家远程视频会诊;
▪ 会诊后如有出国需求,我们协助患者协助办理签证;对接美国最新疗法;
▪ 争取最大的医疗优惠折扣;
▪ 提供便捷、专业的美国就医陪同和生活陪同服务;
▪ 通畅的中美诊疗信息沟通平台和专业的随访服务。
▌ 联系 · 方式
地址: 北京市东城区天坛南里12号美国MEDEBOUND美联医邦美国会诊中心
客服微信: mede_2021
邮箱: support@medebound.com
全国免费咨询热线: 400-616-2591
美国看病常见问题FAQ
赴美看病如何预约 ?
赴美看病多少钱 ?
如何申请美国临床试验 ?
医疗签证和病历翻译 ?
美国二诊和赴美看病如何选择 ?
美联医邦提供【病历翻译,赴美就医服务机构了解到医疗签证,医院预约】一条龙服务,为您省时省力,且预约效率更高,可对接到美国医院主任级别专家,费用仅需3万人民币, 请联系我们了解详情。
远程会诊|出国成功案例:
「 MD安德森癌症中心口腔癌治疗案例 」 「 MD安德森癌症中心黑色素瘤治疗案例 」 「 MD安德森癌症中心肺癌治疗案例 」 「 MD安德森癌症中心鼻咽治疗案例 」 「 MD安德森癌症中心肠癌肝癌治疗案例 」
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。 请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。 本文不用于诊断或治疗疾病,赴美就医服务机构了解到也不影响治疗方案。 美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
本文由美国美联医邦Medebound编辑原创,未经美联医邦允许,不得转载,违者必究。 美国美联医邦借助其30年历史的美国顶级名医网络,用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询,出国就医和新药绿通,为生命续航。 电话:4006162591,微信公众号:搜索“美联医邦”。










 美联医邦
美联医邦