添加微信mede1917
或扫描二维码

添加微信mede1917
或扫描二维码

欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构
欢迎来到 Medebound 国际医疗平台
平安/泰康签约的优选服务机构


 美联医邦
美联医邦
文章类型: 美国新药和前沿
2019年5月24日,美国FDA批准首个基因治疗产品索伐瑞韦(Onasemnogene abeparvovec-xioi,商品名Zolgensma)用于治疗小于2岁SMA儿童,这是最严重的SMA类型且是一种导致婴儿死亡的基因病因。该药也是美国历史上最贵的药,没有之一。(价格见后)
“今天的批准标志着治疗各种疾病的基因和细胞疗法的转化力量的另一个里程碑,出国看病服务机构了解到”代理FDA专员Ned Sharpless医生说道。”“随着每一项新的批准,我们看到这个令人兴奋的科学领域继续超越概念阶段而变为现实。基因治疗产品可能会改变那些可能面临终末疾病或死亡的病人的生活,从而为患者带来了希望。FDA将继续通过使用旨在推进创新、安全和有效治疗方案的审查途径,帮助加快开发未满足医疗需求的产品,从而支持该领域的进展。”
SMA是由存活运动神经元1(SMN1)基因突变引起的罕见遗传性疾病。该基因编码存活运动神经元(SMN)蛋白,这是一种遍布全身的蛋白质,对于称为运动神经元的特异神经细胞的维持和功能至关重要。大脑和脊髓中的运动神经元控制整个身体的肌肉运动。如果没有足够的功能性SMN蛋白,那么运动神经元就会死亡,导致衰弱且通常致命的肌肉无力。由SMN1基因突变引起的SMA通常根据发病年龄和严重程度分为几种亚型。婴儿期发病的SMA是最严重和最常见的亚型。患有这种疾病的儿童抬头、吞咽和呼吸都有问题。这些症状可能在出生时出现,也可能在6个月后出现。
“患有SMA的儿童在执行基本生活功能方面遇到困难。大多数患有这种疾病的儿童由于呼吸衰竭而无法存活过幼儿期。”美国FDA生物制品评估与研究中心主任Peter Marks博士说。“患有SMA的患者现在有另一种治疗选择,可以最大限度地减少SMA的进展并提高生存率。这一批准证明了这一有前途的新医学领域的持续发展势头以及FDA对支持和帮助加快这些产品开发的承诺。”
Zolgensma适用于治疗小于2岁的儿童SMA患者。该产品是一种针对SMA病因的基于腺相关病毒载体的基因疗法。该载体将人SMN基因的全功能拷贝靶向递送到运动神经元细胞中。输注一次Zolgensma可导致SMN蛋白在儿童运动神经元中表达,从而改善肌肉运动和功能,并提高SMA患儿的存活期。给药剂量是基于患者的体重来给药。
Zolgensma的安全性和有效性是基于一项正在进行的临床试验和一项已经完成的临床试验,这两项试验共纳入年龄约2周至8个月的总共36名婴儿期发病的SMA患儿。有效性的主要证据是基于正在进行的临床试验中使用Zolgensma治疗的21名患者的结果。在这项试验中,其余19名患者年龄在9.4至18.5个月; 这19名患者中有13名患者年龄≥14个月。 与婴儿期发作SMA患者的自然病史相比,使用Zolgensma治疗的患者达到发育运动里程碑的能力(例如头部控制和无支撑坐姿的能力)得到了显著改善。
Zolgensma最常见的副作用是肝酶升高和呕吐。Zolgensma有黑框警告,出国看病服务机构了解到该药可能会导致急性严重肝损伤。患有肝功能不全的患者面临严重肝损伤的风险可能较高。在使用Zolgensma治疗前,应完成临床体格检查和评估肝功能的实验室检查,并应在Zolgensma给药后监测患者肝功能至少3个月。
FDA曾给予该药快速通道和优先审查,并授予突破性疗法和“孤儿药”称号。
通用名:Onasemnogene abeparvovec-xioi Suspension for intravenous infusion
(索伐瑞韦 静脉输注混悬液)
商品名:Zolgensma
生产厂家:AveXis Inc.
美国上市日期:2019-05-24
中国大陆未上市
Zolgensma(onasemnogene abeparvovec-xioi)是一种基于腺相关病毒载体的基因治疗,出国看病服务机构了解到用于治疗2岁以下患有脊髓性肌萎缩症(SMA)的儿童患者,其存活运动神经元1(SMN1)基因具有双等位基因突变。
使用限制:
(1)重复给药的安全性和有效性尚未确定。
(2)使用Zolgensma治疗晚期SMA患者(例如四肢完全瘫痪,永久性呼吸机依赖)尚未确定。
Zolgensma仅用于单剂量静脉输注。
(1)Zolgensma的推荐剂量为每kg体重给予1.1×10^14载体基因组。
(2)静脉输注Zolgensma超过60分钟。
(3)从给予Zolgensma的前一天起,出国看病服务机构了解到每天给予全身皮质类固醇激素(等效于口服泼尼松龙1mg/kg)总共30天。在30天结束时,通过临床检查和实验室检查评估肝功。对于无明显异常的患者,在随后的28天将皮质类固醇逐渐减量。若持续肝功异常,继续给予全身皮质类固醇(等效于口服泼尼松龙1mg/kg/天)直至检测无明显异常,然后在随后的28天将皮质类固醇逐渐减量。若使用等效于口服泼尼松龙1mg/kg/天的剂量未获得足够缓解,需请专家会诊。
(1)Zolgensma是一种静脉输注混悬液,单剂量瓶。
(2)Zolgensma以包含2至9个小瓶的试剂盒提供,作为2个小瓶填充体积(5.5mL或8.3mL)的组合。 所有样品瓶的标称浓度为2.0×10^13载体基因组(vg)/ mL。每瓶Zolgensma含有不少于5.5 mL或8.3 mL的可萃取体积。
(1)血小板减少症:使用Zolgensma之前监测血小板计数。给药后第一个月每周监测一次,出国看病服务机构了解到第二个月和第三个月每两周监测一次,直至血小板计数回到基线水平。
(2)肌钙蛋白-I升高:在输注Zolgensma之前监测肌钙蛋白-I,并且在第一个月每周监测一次,然后在第二个月和第三个月每月一次,直到肌钙蛋白-I恢复到基线水平。
最常见不良反应(发生率≥5%)为转氨酶升高和呕吐。
儿科使用:不推荐在早产儿达到足月胎龄之前使用Zolgensma,因为伴随皮质类固醇治疗可能会对神经发育产生不利影响。延迟Zolgensma输注,直至达到足月孕龄。
◆ ◆ ◆
一线生机,出国看病服务机构了解到赴美求医
目前,出国看病服务机构了解到SMA在国内并没有什么有效的治疗方法。这一点在确诊之初,睿智的王先生就已经有所了解。所以王先生毫不犹豫地决定了前往世界上医疗技术发展最为先进的美国求医。
赴美求医,说起来容易,实际上远不是办个签证直接跑去医院挂号看病那样简单。挑选适合自己的医院和医生、翻译病历、预约医院、办理医疗签证等等都是需要花费精力和时间。而对于SMA患儿来说,时间就是生命,根本耗不起。所以在比较和考察了国内多家出国就医机构后,王先生没有多想,最后选择了Medebound美联医邦,因为王先生了解到在美联医邦的背后是美国20多年的前5%顶级医生集团,有丰富的美国医生医院资源; 同时,王先生通过与美联医邦初步接触,美联医邦客户团队的专业度获得了其信任,美联医邦并没有急功近利让我马上出国 而是认为应该先远程找美国专家看看是否适合到美国就诊。
美联医邦为王先生儿子安排的海外第二诊疗的专家为:西奈山医院的Steven. M. Wolf 博士和Patty McGoldrick副主任。
此次会诊的目的在于:
让王先生心里有个预期值,出国看病服务机构了解到去美国看病,最好的结果和最坏的结果是什么;
了解去美国可以接受到哪些治疗?
可能产生的费用问题。
沃尔夫博士和McGoldrick副主任在全面了解了患儿情况后,给出了如下治疗建议:
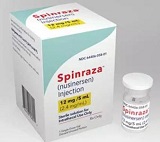
药物治疗:Nusinersen(商品名 Spinraza,出国看病服务机构了解到制造公司 Biogen)
Nusinersen是一种新药物, 于2016年12月23日被FDA批准上市,适用于各种亚型的脊髓性肌萎缩病人。该药通过腰椎穿刺鞘内注射的方式直接注射进入脑脊液,这是一种反义寡核苷酸,其作用机制在于增加存活运动神经元蛋白(SMN)的浓度,该蛋白在脊髓性肌萎缩患者中表达过低。临床试验中期结果显示,经Nusinersen治疗后的患者40%能够达到研究中定义的运动功能发展里程碑指标(译注:例如翻身、站立)改善,同时对照组没有患者达到运动指标改善。
沃尔夫博士和McGoldrick副主任同时对患者的其他方面给予指导:
营养:这是脊髓性肌萎缩中值得关注的一点,可能需要行胃造口术置管;
呼吸:呼吸功能可能恶化,出国看病服务机构了解到可能需要气管切开或无创呼吸支持;
脊柱侧弯:可能需要手术,这取决于脊柱侧弯进展的程度、肺功能以及骨骼成熟度;
随访监测:每6个月评估营养状况、呼吸功能以及骨科状况,对于较为虚弱的患儿,随访间隔可以更短;
其他:密切的物理疗法、职业疗法以及喂养(言语疗法),采用胸腔共振设备如 VEST(制造商 Hill-Rom)或者类似的设备来预防肺炎;
至于患者最关心的愈后问题,会诊专家给出如下回复:
Nusinersen疗法每四个月一次,腰穿鞘内注射给药。到目前为止我们并不清楚治疗需要多长时间。这有可能需要终生治疗,直到我们发现更为完善的基因疗法来永久性地修复这一基因缺陷。在过去 4 年间,我们看到了接受治疗的患者表现出良好甚至完全正常的发育轨迹,这取决于治疗开始的时机,越早开始治疗越好。研究者觉得对于 SMA2 型患儿,如果还没有出现发育中重大里程碑事件的缺失,那么这些患儿经过治疗能够达到这些发育里程碑事件(译注:例 如独坐、行走)。在我们治疗的这些患儿中,没有出现发育里程碑事件丧失,许多患儿出现了改善以及正常的功能发育,但与正常小孩仍有差别,患儿会有某种程度的残疾,但残疾的程度较不治疗的患儿更为轻微,不需要支持治疗。这些治疗4年的小孩现在不需要胃管进食,也不需要呼吸机辅助呼吸,但其目前的运动功能仍较为受限。另外,请知悉,这些小孩通常非常聪明,智商在平均水平之上,这也是这种疾病的一个奇特之处。
Nursinersen是用于治疗患有脊髓肌肉萎缩SMA的婴儿和儿童,出国看病服务机构了解到靶向作用于SMN2基因,将其转化为SMN1基因,该基因之后结合到SMN2基因转 录出的RNA模版上,并促进7号外显子翻译进入最终的SMN(存活运动神经元)蛋白质产物中,增加其蛋白水平。目前没有NIH资助的关注SMN1蛋白的研究,目前的研究只有应用SMN2蛋白来补偿缺陷SMN1基因的疗法,并且结果显示该疗法能够解决SMN1基因的问题。
目前发表的文章和研究主持者都建议越早开始治疗越好,但即使是在美国,考虑到高昂的价格,学界对于哪些患者应当接受这一疗法仍有争议。如果患儿已经需要生命维持和胃管进食,那么他们觉得这种患儿就太晚期了,治疗价值不大。他们还建议,在患儿出现明显的运动 功能/能力丧失之前开始治疗。我们也同意这种疗法的确昂贵,在可预期的未来,下一代的治疗药物会便宜一些。
美联医邦随即展开调查,出国看病服务机构了解到发现有的美国医院目前暂时不接受国际患者使用该新药,因此之后又咨询了几个相关医院和教授。几家大医院,诸如波士顿儿童医院国际部,西雅图儿童医院及纽约长老会医院小儿神经科,美联医邦都拿到了这些顶级医院的报价。美联医邦通过综合比较,最终美联医邦推荐王先生选择加州大学洛杉矶医学中心,因为同样级别的医疗机构里,这里的药价更客观合理。
王先生跟家里人几经商量后,最终决定要赴美接受治疗。
◆ ◆ ◆
跟随希望,背水一战
前期在美联医邦的帮助下,从联系医院、办理签证,到安排美国住宿,出行等等事宜都无比顺利。

落地美国,出国看病服务机构了解到接机服务齐备

住所

住的地方附近,出国看病服务机构了解到即便是不会英文的老人家也能很快适应
生活安排妥当后,出国看病服务机构了解到差不多也到了王先生同加州大学洛杉矶医学中心预约就诊的时间。就诊当天,美联医邦安排了专车接送,以及华人翻译和陪同人员,为王先生及其家人提供专业的医疗翻译和生活翻译。当天,加州大学洛杉矶医学中心专家告诉王先生:“目前,美国有关于治疗SMA疾病的最新开展的临床试验,可以作为选项之一。“王先生犹豫了,是接受Nusinersen治疗,还是进行临床试验呢?

就诊环境

王先生小儿在母亲陪同下等候抽血做相关检查
完成医院相关手续和检查后,出国看病服务机构了解到在等待检查结果期间,恰逢美国经典的黑色星期五。美联医邦工作人员带着王先生一家人感受了一下异国风情。
某公园留念照片
加州出了名的四季如春,每一天都是蓝天白云阳光灿烂


一个周左右时间,加州大学洛杉矶医学中心给王先生打来电话,告诉他Nusinersen已经准备好,王先生可以带小孩去接受治疗了。此时王先生考虑到SMA的治疗还是宜早不宜迟,故放弃了参加临床试验,决心接受Nusinersen治疗。

Nusinersen治疗示意图,该治疗为长疗程治疗
截至2018年1月下旬,患儿已经接受了前3次注射,正在等待接受第4次注射。王先生在谈到国内外就医体验的区别时提到:“在国内,你心里有疑惑时也只能简短地问医生几句,不能细问,因为医生不可能花太多时间在你身上。而美国医生的原则是‘有问必答’。他会一直回答你的问题,直到把你所有的疑虑都打消。”
问及是什么支撑王先生一路坚持下去的时候,出国看病服务机构了解到他说道:“首先感谢我的家人,这是肯定的,家是最坚强的后盾。我的妻子最辛苦,照顾孩子,身体和心灵都很疲累,但是我相信妻子和我一样,只要能治好我们的孩子,我们一定会坚持下去”,“其次就是遇到了一个好的机构—Medebound美联医邦。他们帮我联系了多个美国顶级医院,如西雅图儿童医院、纽约长老会医院、波士顿儿童医院、加州大学洛杉矶医学中心。他们咨询这些医院的价格,进行比价,对比服务,医生等等,最终挑选了一家性价比最高的医院—加州大学洛杉矶医学中心。看似轻松地出国就医,其实是建立在非常繁杂的准备工作之上的。在赴美之前,美联医邦替我小孩安排了与美国专家的书面会诊,让我感受到了美国专家的专业与前沿思维,解决了我的很多疑问,也更加坚定了我赴美求医的决心。赴美之后,美联医邦贴心地给我们安排了陪诊人员,不仅陪我们到医院就诊,解决翻译问题,还领着我们一起熟悉当地的生活环境,尽快的适应这里的生活,他们陪我们去买菜,购物,逛公园等等,衣食住行都替我们考虑得十分周到,完全像是家人一般的存在,非常温暖贴心。所以说,找对机构真的很重要!”末了,王先生再次强调。
本文由美国美联医邦Medebound原创,出国看病服务机构了解到未经美联医邦允许,不得转载,违者必究。免责声明:本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
![]()
美国美联医邦借助其30年历史的美国顶级名医网络,出国看病服务机构了解到用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询和新药绿通,为生命续航。微信公众号:搜索“美联医邦”,贵宾热线:400-616-2591。
 签约中国平安泰康等保险巨头,覆盖200多万客户
签约中国平安泰康等保险巨头,覆盖200多万客户

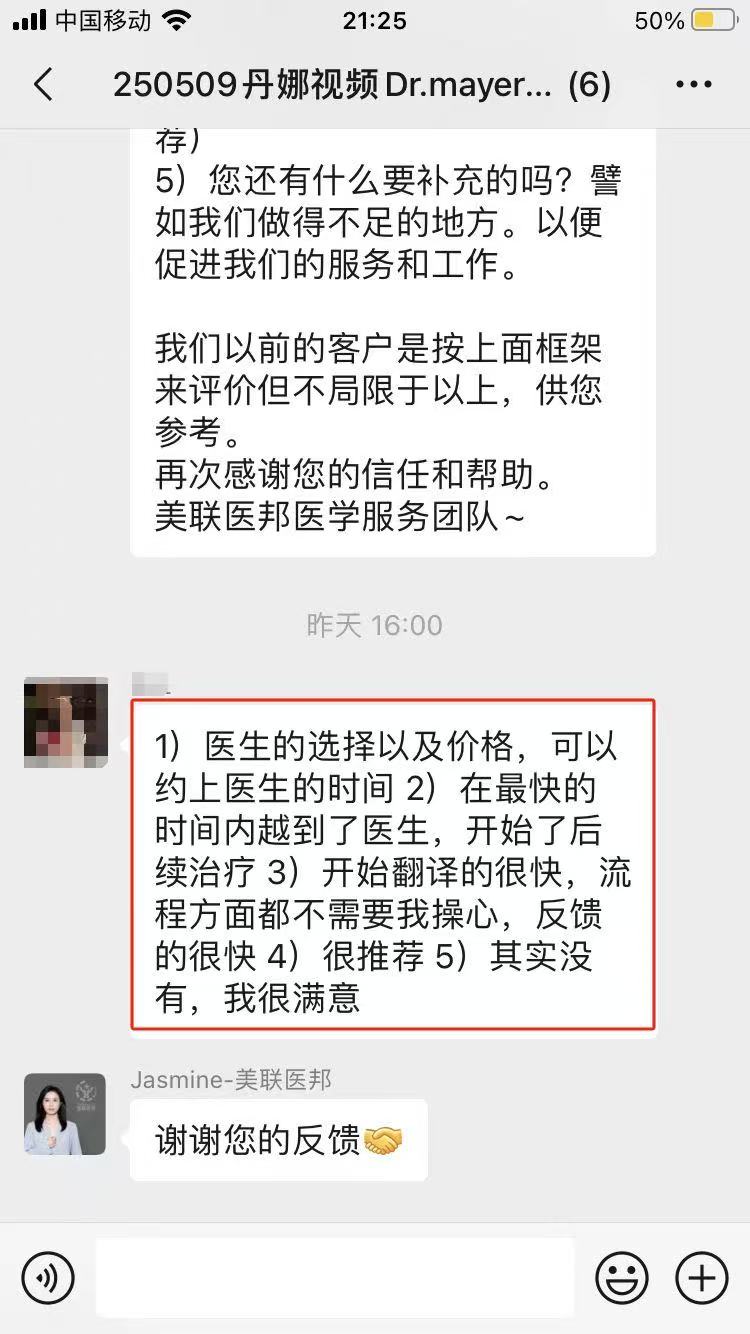
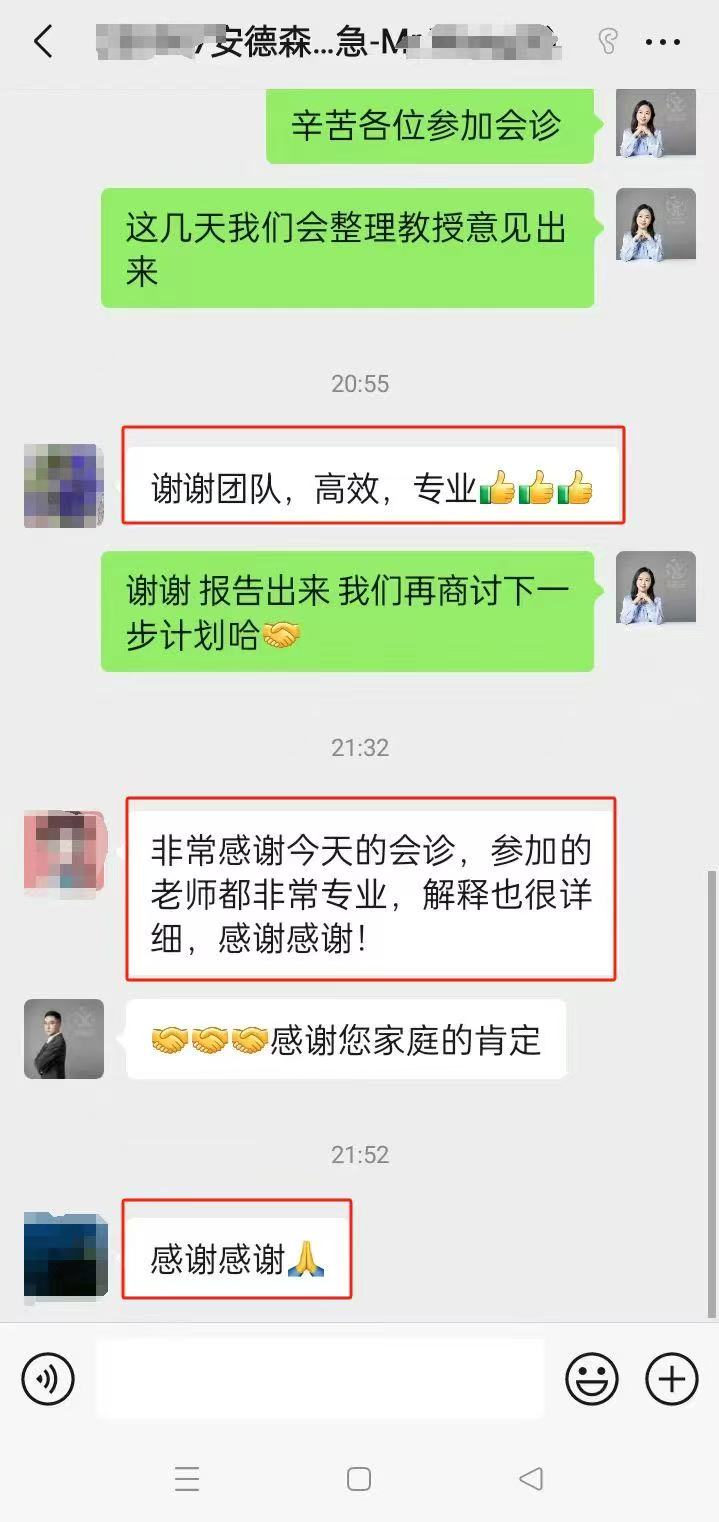
成功帮助1000+名患者

100%成功境外支付,出国看病服务机构了解到95%患者好评率
相似【案例】
☞国内患者远程咨询美国排名前三癌症中心斯隆凯瑟琳,获美国最新肺癌新药
部分美联医邦美国名医真实案例
☞美国美联医邦|Medebound与中国保险巨头泰康人寿正式签约
☞膀胱癌患者通过视频会诊中美两国三地联线哈佛名医,寻求治疗方案及临床试验建议
☞美国约翰霍普金斯医院专家视频远程为白血病患者提出治愈性方案



凭借我们30多年的美国医疗网络资源,您可以直接与美国医疗精英对话,在家中咨询美国顶级专家或国际会诊,不出国门获取先进治疗方案。
凭借我们30年的医疗网络资源,您可以直接与美国医疗精英对话。在家中咨询疑难疾病的专家,轻松了解治疗方案。
如需赴美就医或获取海外新药,我们为您一站式安排海外看病等服务。



服务优势
预约知名美国专家譬如安德森癌症医院和梅奥诊所,安排无忧出国看病行程,寻找全球新药新技术医生网络
我们与美国顶级1%的海外医疗医生网络,300+所美国权威医院和药房资源深度合作一站式海外诊疗我们的专属客服医学经理,为您免费咨询,最短时间获取预约优质医疗资源

Jason 王经理
医学客服经理/添加微信:Mede2018

Kiki 圆经理
医学客服经理/添加微信:mede1917

如果您和您的家人有任何医疗和新药需求,请欢迎随时联系我们。我们客服团队工作时间周一到周五早上9点到晚上8点,北京时间。
总部位于纽约,9年专注美国,是赴美就医服务细分领域的头部机构。 始终坚持精英式定制(非保姆式),获30+历史卡思克鲁力医生集团(全美TOP医生联盟)及股东战略产业投资,不涉及风险资本。 作为美国本土医疗资源提供商,美联医邦已与中国平安、泰康人寿、太平人寿等保险集团达成总对总合作。服务覆盖数百万保险客户。美国福布斯榜推荐和英文报道,直通全美前5%顶级专家网络。只精准对接全美72个专科排名TOP3医院,包括梅奥诊所、MD安德森、纪念斯隆-凯特琳癌症中心等百余家美国著名医疗机构。申请美国医院的折扣率10-30%,和美国医院议价能力高。3000+客户的信任选择,一切从用户角度出发,鼓励部分患者远程二诊/问诊拿方案在国内治疗,不过度宣传和劝退不必要的赴美看病。
了解更多美国美联医邦成都运营服务中心
Disclaimer 免责声明:
本文无意影响或改变您的主治医生提供的医疗服务。请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。本文不用于诊断或治疗疾病,也不影响治疗方案。美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。

纽约总部:
260 Madison Ave 8th Floor #8001,New York, NY 10016
美联医邦Medebound成都运营服务中心:
成都市锦江区红星路一段35号A区1号楼605
(美)+1 917-342-2381
(中) +86 400-616-2591
support@medebound.com