导读:美国FDA近日批准帕博利珠单抗(商品名:可瑞达)用于一线治疗转移性或不可手术切除的复发性头颈部鳞状细胞癌(HNSCC)。这一重大进展为海外看病患者带来了新的治疗选择。这一决定将使得更多海外患者能够获得最新的治疗方案,提高他们的生存机会。
2019年6月10日,美国FDA批准帕博利珠单抗(商品名:可瑞达)用于一线治疗转移性或不可手术切除的复发性头颈部鳞状细胞癌(HNSCC)。可瑞达是第一个获批一线治疗转移性或不可切除的复发性头颈癌的PD-1疗法,也是第一个被证明对于这些患者在OS方面有统计学显著改善的PD-1药物。
本次批准是基于KEYNOTE-048 (NCT02358031)这一随机、多中心、三臂、开放标签、对照试验,该试验纳入882例转移性HNSCC患者,这些患者之前未因转移或复发而接受过全身治疗。
美国FDA批准的帕博利珠单抗(可瑞达)为HNSCC海外看病患者带来了新的治疗选择和希望。
患者被随机(1:1:1)分配到三个治疗组:帕博利珠单抗单药治疗组;帕博利珠单抗+卡铂或顺铂+FU;西妥昔单抗+卡铂或顺铂+FU。通过肿瘤PD-L1表达(TPS≥50%或<50%)、HPV状态(根据p16免疫组化结果阳性或阴性)和ECOG PS(0 vs 1)进行分层。
总生存期(OS)作为主要疗效指标,分别在CPS≥20 HNSCC患者亚组、CPS≥1 HNSCC患者亚组和总体人群中观察。
该试验在预先设定的中期分析中发现,所有患者中,与西妥昔单抗+化疗相比,接受帕博利珠单抗+化疗组的患者OS有统计学意义的显著改善。帕博利珠单抗+化疗组的中位OS为13.0个月,西妥昔单抗+化疗组为10.7个月(HR 0.77; p=0.0067)。CPS≥20亚组(HR 0.69)和CPS≥1亚组(HR 0.71)的结果相似。
该试验还发现,在PD-L1 CPS≥1 HNSCC亚组和PD-L1 CPS≥20 HNSCC亚组中,帕博利珠单抗单药治疗组与西妥昔单抗+化疗组对比,患者OS有统计学意义的显著改善。 在CPS≥1亚组中,帕博利珠单抗组的中位OS为12.3个月,西妥昔单抗+化疗组的中位OS为10.3个月(HR 0.78; p=0.0171)。在CPS≥20亚组中,帕博利珠单抗组的中位OS为14.9个月,西妥昔单抗+化疗组的中位OS为10.7个月(HR 0.61; p=0.0015)。在中期分析时,在总体人群中,帕博利珠单抗单药治疗组与西妥昔单抗+化疗组之间的OS没有统计学差异。在任何人群中,西妥昔单抗+化疗组与含有帕博利珠单抗组的PFS(无进展生存期)均无统计学差异。
帕博利珠单抗(可瑞达)中国大陆参考价格:大陆获批规格为100mg/4ml,定价17918元/支。对符合条件的肺癌患者,在自行使用5个疗程后,中国初级卫生保健基金会可为其援助5个疗程,后续患者每自行使用3个疗程药物,基金会可继续为其援助3个疗程,累计时间不超过24个月。
附:帕博利珠单抗(可瑞达)美国FDA使用说明(2019-06-10)
通用名:帕博利珠单抗(Pembrolizumab)
商品名:可瑞达(Keytruda)
生产厂家:默沙东(MSD)
美国上市日期:2014年9月4日
中国上市日期:2018年7月20日
适应症:
可瑞达是一种程序性死亡受体-1(PD-1)阻断抗体,适用于:
1. 黑色素瘤:
(1)无法切除或转移的黑色素瘤。
(2)黑色素瘤累及淋巴结患者全切术后的辅助治疗。
2. 非小细胞肺癌(NSCLC):
(1)与培美曲塞和铂类化疗联用,一线治疗转移性非鳞癌NSCLC,且肿瘤没有EGFR或ALK基因突变。
(2)与卡铂和紫杉醇(或白蛋白型紫杉醇)联用,一线治疗转移性鳞癌。
(3)单药使用,一线治疗不能手术切除或放化疗的Ⅲ期NSCLC或转移性NSCLC患者,要求这些患者的肿瘤表达PD-L1(肿瘤比例评分TPS≥1%)且没有EGFR或ALK基因变异。
(4)单药使用,治疗转移性非小细胞肺癌,这些患者在铂类化疗期间或化疗后病情进展并且肿瘤有PD-L1表达(TPS≥1%)。肿瘤有EGFR或ALK基因突变的患者应首先使用FDA批准的治疗方案治疗,此后若疾病进展再给予可瑞达治疗。
3. 头颈部鳞状细胞癌(HNSCC):
(1)与铂类和FU联用,用于转移性或不可手术切除的复发性HNSCC患者的一线治疗。
(2)单药治疗,用于转移性或不可手术切除的复发性HNSCC且肿瘤表达PD-L1(CPS≥1)患者的一线治疗。
(3)单药治疗,用于铂类化疗期间或化疗后疾病进展的复发或转移性HNSCC患者。
4. 经典型霍奇金淋巴瘤(cHL):用于治疗成人和儿童难治性cHL患者,或之前经3种或以上的治疗方案治疗后复发。
5. 原发性纵隔大B细胞淋巴瘤(PMBCL):
(1)用于治疗成人和儿童难治性PMBCL,或之前经2种或以上的治疗方案治疗后复发。
(2)使用限制:可瑞达不推荐用于治疗需要紧急细胞减灭治疗的患者。
6. 尿路上皮癌:
(1)用于治疗局部晚期或转移性尿路上皮癌,患者不适合含顺铂的化疗且肿瘤有PD-L1表达(综合阳性分数CPS评分≥10),或者患者不适合任何铂类化疗不管PD-L1的表达状态。
(2)用于治疗在铂类化疗期间或之后疾病进展的,或在新辅助化疗或铂类辅助化疗后12个月内疾病进展的局部晚期或转移性尿路上皮癌。
7. 微卫星不稳定性高的恶性肿瘤:
(1)用于治疗无法切除或转移的,微卫星不稳定性高(MSI-H)或错配修复缺陷的成人和儿童患者。
①经之前治疗后疾病进展且没有令人满意的替代治疗方案的实体肿瘤,或
②经氟嘧啶、奥沙利铂和伊立替康治疗后疾病进展的结直肠癌。
(2)使用限制:可瑞达在儿童MSI-H中枢神经系统恶性肿瘤患者中的安全性和有效性尚未确定。
8. 胃癌:用于治疗复发性局部晚期或转移性胃或胃食管交界区腺癌,且经FDA批准的试验确定PD-L1表达(CPS评分≥1),患者经使用两种或以上治疗方案(包括氟嘧啶类和铂类化疗以及HER2/neu靶向治疗)过程中或治疗结束后疾病出现进展。
9. 宫颈癌:用于治疗复发或转移性宫颈癌,经FDA批准的试验确定PD-L1表达(CPS评分≥1),在化疗过程中或化疗后出现疾病进展。
10. 肝细胞癌(HCC):用于治疗HCC,患者在之前已接受过索拉菲尼治疗。
11. Merkel细胞癌(MCC):用于复发的局部晚期或转移性Merkel细胞癌的成人和儿童患者。
12. 肾细胞癌(RCC):与阿昔替尼联用,用于一线治疗晚期肾癌。
用法用量:
1. 黑色素瘤:200mg,每3周1次。
2. 非小细胞肺癌(NSCLC):200mg,每3周1次。
3. 头颈部鳞癌 (HNSCC):200mg,每3周1次。
4. 经典型霍奇金淋巴瘤(cHL)或原发性纵隔大B细胞淋巴瘤(PMBCL):成人200mg,每3周1次;儿童2mg/kg(最大剂量200mg),每三周一次。
5. 尿路上皮癌:200mg,每3周1次。
6. 微卫星不稳定性高(MSI-H)的恶性肿瘤:成人200mg,每3周1次,儿童2mg/kg(最大剂量200mg),每3周一次。
7. 胃癌:200mg,每3周1次。
8. 宫颈癌:200mg,每3周1次。
9. 肝癌(HCC):200mg, 每3周1次。
10. Merkel细胞癌(MCC):成人200mg, 每3周1次;儿童2mg/kg(最大剂量200mg),每3周一次。
11. 肾细胞癌(RCC):200mg每3周一次;联合阿昔替尼5mg/次,2次/天。
静脉输注可瑞达的时间应大于30分钟。
剂型规格:
1. 50mg冻干粉末,单剂量小瓶,注射用。
2. 注射液:100mg/4mL(25mg/mL)溶液,单剂量小瓶。
禁忌症:无。
注意事项:
1. 免疫介导性肺炎:中度肺炎暂停使用,严重、危及生命或复发的中度肺炎永久停用。
2. 免疫介导性结肠炎:中度或重度结肠炎暂停使用,危及生命的结肠炎永久停用。
3. 免疫介导性肝炎:监测肝功变化。根据肝酶升高的严重程度,暂停或永久停用。
4. 免疫介导性内分泌疾病:
(1)垂体炎:中度垂体炎暂停使用,严重或危及生命的垂体炎暂停或永久停用。
(2)甲状腺疾病:监测甲功变化。严重或危及生命的甲状腺功能亢进症暂停或永久停用。
(3)1型糖尿病:监测高血糖。严重高血糖暂停使用。
5. 免疫介导性肾炎:监测肾功变化。中度肾炎暂停使用,严重或危及生命的肾炎永久停用。
6. 免疫介导性皮肤不良反应,包括史蒂文斯-强生综合征(SJS)和中毒性表皮坏死(TEN):严重的皮肤反应暂停使用,危机生命的皮肤反应永久停用。
7. 其他免疫介导性不良反应:在器官移植受者中,要考虑权衡使用可瑞达治疗的益处与可能存在器官排斥反应的风险。
8. 输液相关反应:对严重或危及生命的输液反应停止输液并永久停用可瑞达。
9. 异体造血干细胞移植(HSCT)并发症:
(1)使用可瑞达后接受异体HSCT治疗:监测肝静脉闭塞性疾病,3-4级急性移植物抗宿主病(GVHD),包括超急性GVHD,类固醇需求型发热综合征,和其他免疫介导的不良反应。已发生过与移植相关的死亡病例。
(2)使用可瑞达前接受过异体HSCT治疗:在接受过异体HSCT治疗的患者中,要考虑权衡使用可瑞达治疗的益处与GVHD的风险。
10. 不推荐在临床对照试验以外使用PD-1或PD-L1阻断性抗体与沙利度胺类似物和地塞米松联用治疗多发性骨髓瘤。
11. 胚胎毒性:可瑞达可造成胎儿伤害。建议生殖期女性注意对胎儿的潜在风险。
不良反应:
最常见的不良反应(≥20%)有:
(1)单药使用时:疲劳、肌肉骨骼疼痛、食欲减退、瘙痒、腹泻、恶心、皮疹、发热、咳嗽、呼吸困难、便秘、疼痛和腹痛。
(2)与化疗联用时:疲劳/虚弱、恶心、便秘、腹泻、食欲减退、皮疹、呕吐、咳嗽、呼吸困难、发热、脱发和周围神经病变。
(3)与阿昔替尼联用:腹泻、疲劳/虚弱、高血压、甲状腺功能减退、食欲下降、肝毒性、手掌-足底红斑感觉迟钝、恶心、口腔炎/粘膜炎症、发声困难、皮疹、咳嗽和便秘。
这次美国FDA的批准对于国外患者而言无疑是一个重大的利好消息,这意味着他们也能够获得最新的治疗方案,享受到先进的医疗技术和药物。这一决定将不仅在美国,而且在全球范围内产生深远的影响,为海外看病患者提供了更多的治疗选择和希望,也促进了全球医疗技术的交流与发展。
▌我们可以提供
▪ 收集病史资料,撰写国际转诊病历报告;
▪ 准确选择美国对口医院,快速预约美国专家远程视频会诊;
▪ 会诊后如有出国需求,我们协助患者协助办理签证;对接美国最新疗法;
▪ 争取最大的医疗优惠折扣;
▪ 提供便捷、专业的美国就医陪同和生活陪同服务;
▪ 通畅的中美诊疗信息沟通平台和专业的随访服务。
▌ 联系 · 方式
地址: 北京市东城区天坛南里12号美国MEDEBOUND美联医邦美国会诊中心
客服微信: Mede2018
邮箱: support@medebound.com
全国免费咨询热线: 400-616-2591
美国看病常见问题FAQ
赴美看病如何预约 ?
赴美看病多少钱 ?
如何申请美国临床试验 ?
医疗签证和病历翻译 ?
美国二诊和赴美看病如何选择 ?
美联医邦提供【病历翻译,医疗签证,医院预约】一条龙服务,为您省时省力,且预约效率更高,可对接到美国医院主任级别专家,费用仅需3万人民币, 请联系我们了解详情。
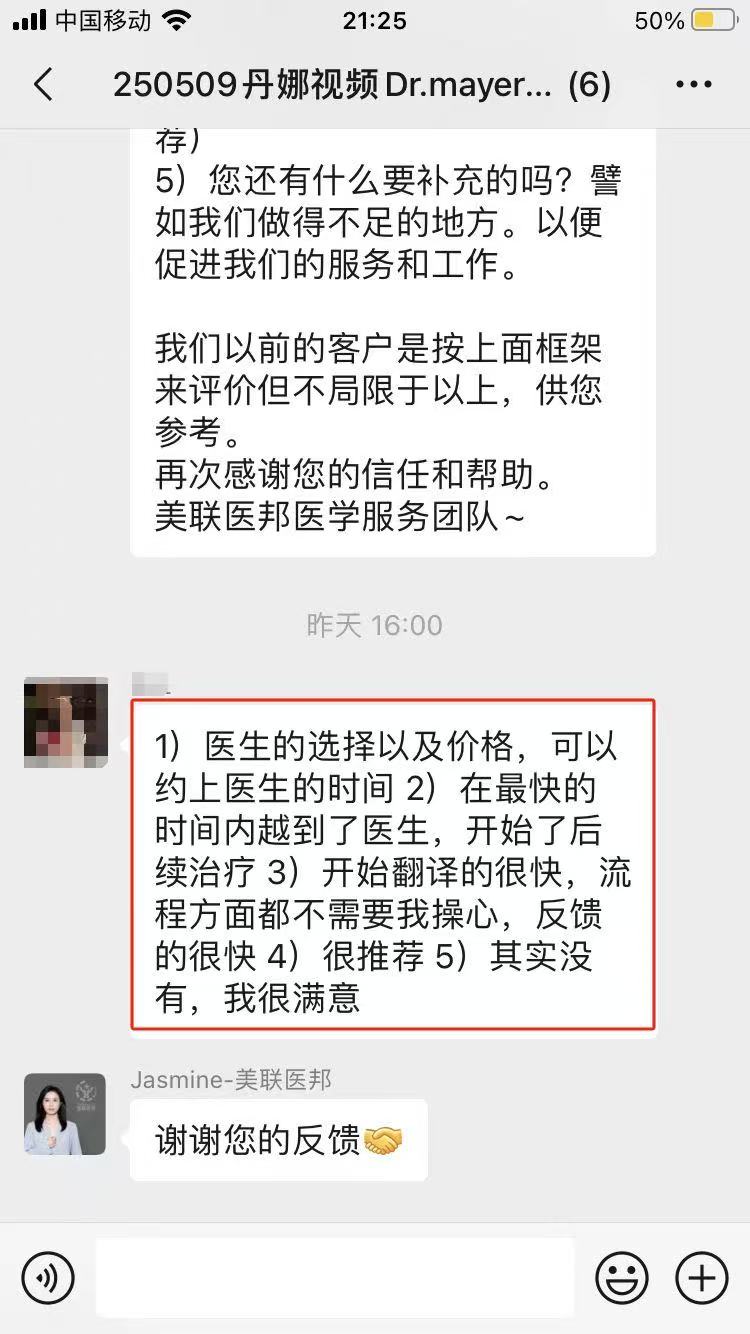
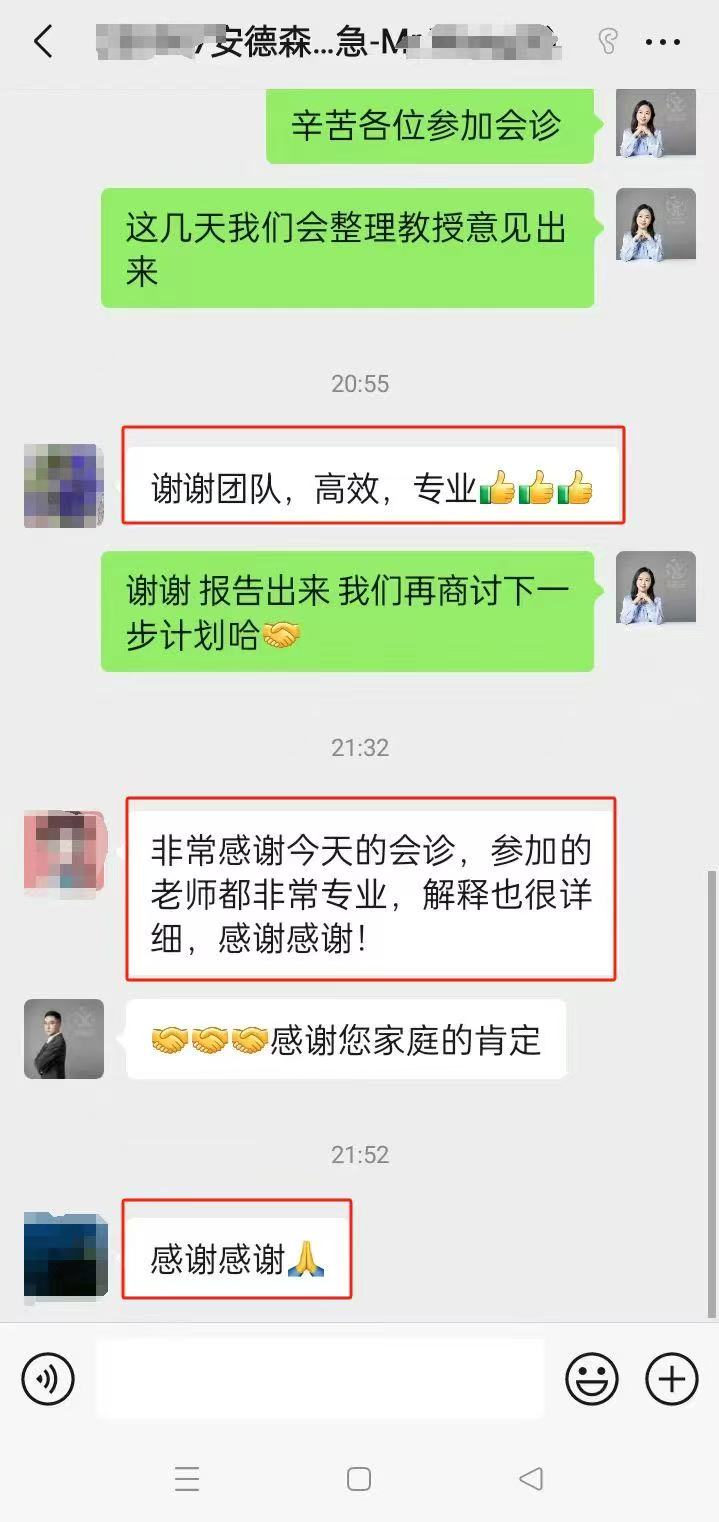
远程会诊|出国成功案例:
「 MD安德森癌症中心口腔癌治疗案例 」 「 MD安德森癌症中心黑色素瘤治疗案例 」 「 MD安德森癌症中心肺癌治疗案例 」 「 MD安德森癌症中心鼻咽治疗案例 」 「 MD安德森癌症中心肠癌肝癌治疗案例 」
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。 请不要在没有先咨询您的主治医疗服务
![]()









 美联医邦
美联医邦