通用名:帕博利珠单抗(Pembrolizumab)
商品名:可瑞达(Keytruda)
生产厂家:默沙东(MSD)
美国上市日期:2014年9月4日
中国上市日期:2018年7月20日
Pembrolizumab(KEYTRUDA)是一种人源化的IgG4型单克隆抗PD-1抗体。
美国看病服务机构了解到:2019年4月19日,美国FDA批准了帕博利珠单抗(可瑞达)联合阿昔替尼用于晚期肾细胞癌(RCC)患者的一线治疗。
截止2018年12月22日,出国看病服务机构了解到美国FDA批准的适应症如下:
1.黑色素瘤:无法切除或转移的黑色素瘤患者。
2. 非小细胞肺癌(NSCLC):
(1)与培美曲塞和铂类化疗联用,一线治疗转移性非鳞癌NSCLC,且肿瘤没有EGFR或ALK基因突变。
(2)与卡铂和紫杉醇(或白蛋白型紫杉醇)联用,一线治疗转移性鳞癌。
(3)单药使用,出国看病服务机构了解到一线治疗转移性NSCLC,要求经美国FDA批准的试验确定肿瘤具有高PD-L1表达(TPS评分≥50%),且肿瘤没有EGFR或ALK基因突变。
(4)单药使用,治疗转移性非小细胞肺癌,患者在铂类化疗期间或化疗后病情进展并且经美国FDA批准的试验确定肿瘤PD-L1表达(TPS≥1%)。肿瘤有EGFR或ALK基因突变的患者应首先使用FDA批准的治疗方案治疗,此后若疾病进展再给予可瑞达治疗。
3. 头颈部鳞状细胞癌(HNSCC):用于治疗在铂类化疗期间或化疗后病情进展的复发或转移性HNSCC患者。
4. 经典型霍奇金淋巴瘤(cHL):用于治疗成人和儿童难治性cHL患者,出国看病服务机构了解到或之前经3种或以上的治疗方案治疗后复发。
5. 原发性纵隔大B细胞淋巴瘤(PMBCL):
(1)用于治疗成人和儿童难治性PMBCL,或之前经2种或以上的治疗方案治疗后复发。
(2)使用限制:可瑞达不推荐用于治疗需要紧急细胞减灭治疗的患者。
6. 尿路上皮癌:
(1)用于治疗局部晚期或转移性尿路上皮癌,患者不适合含顺铂的化疗且经美国FDA批准的试验确定肿瘤PD-L1表达(CPS评分≥10),或者患者不适合任何铂类化疗不管PD-L1的表达状态。
(2)用于治疗在铂类化疗期间或之后疾病进展的,或在新辅助化疗或铂类辅助化疗后12个月内疾病进展的局部晚期或转移性尿路上皮癌。
7. 微卫星不稳定性高的恶性肿瘤:
(1)用于治疗无法切除或转移的,微卫星不稳定性高(MSI-H)或错配修复缺陷的成人和儿童患者。
①经之前治疗后疾病进展且没有令人满意的替代治疗方案的实体肿瘤,或
②经氟嘧啶、奥沙利铂和伊立替康治疗后疾病进展的结直肠癌。
(2)使用限制:可瑞达在儿童MSI-H中枢神经系统恶性肿瘤患者中的安全性和有效性尚未确定。
8. 胃癌:用于治疗复发性局部晚期或转移性胃或胃食管交界区腺癌,且经FDA批准的试验确定PD-L1表达(CPS评分≥1),患者经使用两种或以上治疗方案(包括氟嘧啶类和铂类化疗以及HER2/neu靶向治疗)过程中或治疗结束后疾病出现进展。
9. 宫颈癌:用于治疗复发或转移性宫颈癌,出国看病服务机构了解到经FDA批准的试验确定PD-L1表达(CPS评分≥1),在化疗过程中或化疗后出现疾病进展。
10. 肝细胞癌(HCC):用于治疗HCC,患者在之前已接受过索拉菲尼治疗。
用法与用量:
1.黑色素瘤:200mg,出国看病服务机构了解到每3周1次。
2. 非小细胞肺癌(NSCLC):200mg,每3周1次。
3. 头颈部鳞癌 (HNSCC):200mg,每3周1次。
4. 经典型霍奇金淋巴瘤(cHL)或原发性纵隔大B细胞淋巴瘤(PMBCL):成人200mg,每3周1次;儿童2mg/kg(最大剂量200mg),每三周一次。
5. 尿路上皮癌:200mg,出国看病服务机构了解到每3周1次。
6. 微卫星不稳定性高(MSI-H)的恶性肿瘤:成人200mg,每3周1次,儿童2mg/kg(最大剂量200mg),每3周一次。
7. 胃癌:200mg,每3周1次。
8. 宫颈癌:200mg,每3周1次。
9. 肝癌(HCC):200mg, 每3周1次。
静脉输注可瑞达的时间应大于30分钟。
剂型规格:
1. 50mg冻干粉末,出国看病服务机构了解到单剂量小瓶,注射用
2.注射液:100mg/4mL(25mg/mL)溶液,单剂量小瓶
禁忌症:
无。
注意事项:
1.免疫介导性肺炎:中度肺炎暂停使用,出国看病服务机构了解到严重、危及生命或复发的中度肺炎永久停用。
2. 免疫介导性结肠炎:中度或重度结肠炎暂停使用,危及生命的结肠炎永久停用。
3. 免疫介导性肝炎:监测肝功变化。根据肝酶升高的严重程度,暂停或永久停用。
免疫介导性内分泌疾病:
(1)垂体炎:中度垂体炎暂停使用,严重或危及生命的垂体炎暂停或永久停用。
(2)甲状腺疾病:监测甲功变化。严重或危及生命的甲状腺功能亢进症暂停或永久停用。
(3)1型糖尿病:监测高血糖。严重高血糖暂停使用。
4. 免疫介导性肾炎:监测肾功变化。中度肾炎暂停使用,严重或危及生命的肾炎永久停用。
5. 免疫介导性皮肤不良反应,包括史蒂文斯-强生综合征(SJS)和中毒性表皮坏死(TEN):严重的皮肤反应暂停使用,危机生命的皮肤反应永久停用。
6. 其他免疫介导性不良反应:在器官移植受者中,出国看病服务机构了解到要考虑权衡使用可瑞达治疗的益处与可能存在器官排斥反应的风险。
7. 输液相关反应:对严重或危及生命的输液反应停止输液并永久停用可瑞达。
8. 异体造血干细胞移植(HSCT)并发症:
(1)使用可瑞达后接受异体HSCT治疗:监测肝静脉闭塞性疾病,3-4级急性移植物抗宿主病(GVHD),包括超急性GVHD,类固醇需求型发热综合征,和其他免疫介导的不良反应。已发生过与移植相关的死亡病例。
(2)使用可瑞达前接受过异体HSCT治疗:在接受过异体HSCT治疗的患者中,出国看病服务机构了解到要考虑权衡使用可瑞达治疗的益处与GVHD的风险。
9. 不推荐在临床对照试验以外使用PD-1或PD-L1阻断性抗体与沙利度胺类似物和地塞米松联用治疗多发性骨髓瘤。
10. 胚胎毒性:可瑞达可造成胎儿伤害。建议生殖期女性注意对胎儿的潜在风险。
不良反应:
最常见的不良反应(≥20%):
1.单药使用时:疲劳、肌肉骨骼疼痛、食欲减退、瘙痒、腹泻、恶心、皮疹、发热、咳嗽、呼吸困难、便秘、疼痛和腹痛。
2. 与化疗联用时:疲劳/虚弱、恶心、便秘、腹泻、食欲减退、皮疹、呕吐、咳嗽、呼吸困难、发热、脱发和周围神经病变。
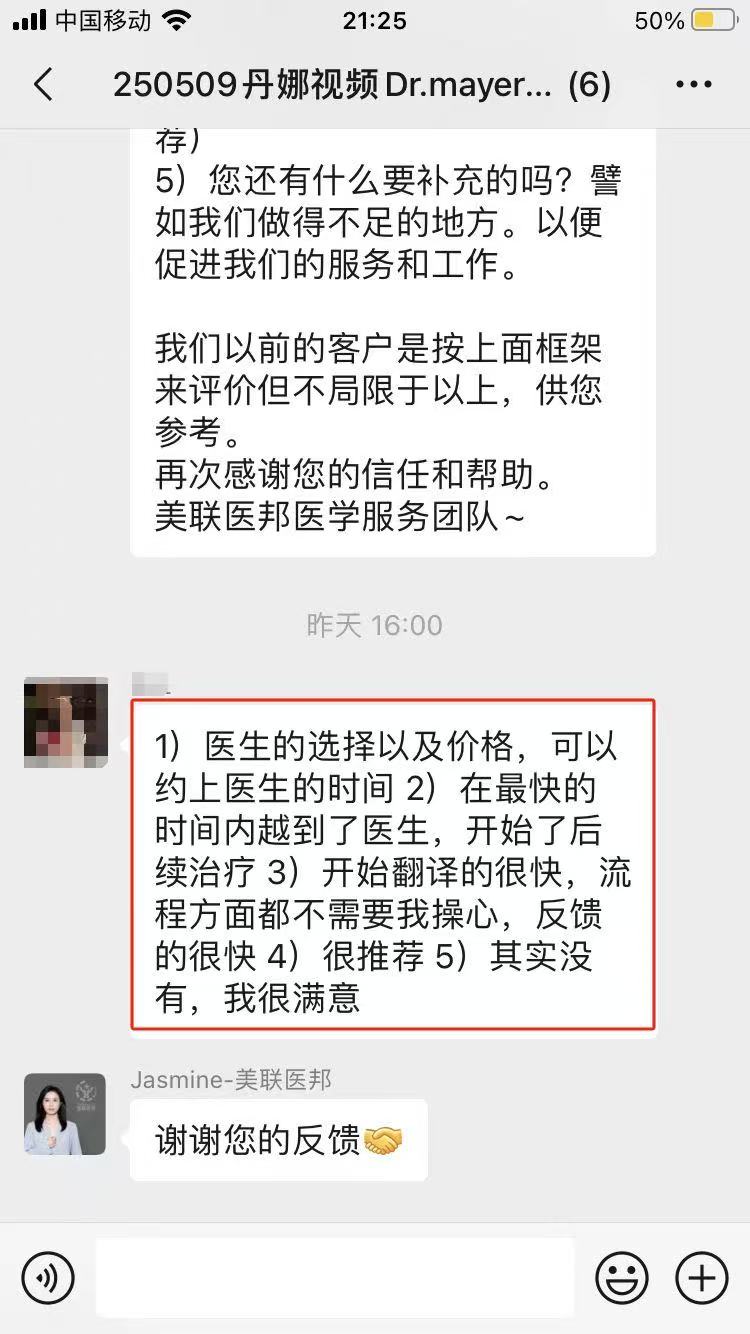
来自美联医邦的一段话
以上免疫治疗药物PD-L1帕博利珠单抗的介绍,可以帮助美国看病患者更好地做出明智的医疗决策。美联医邦服务了上千海外国际二诊,美国视频会诊和赴美看病的患者,如有需要请联系我们(400热线:4006162591,电话进来后请告知文章码1219获取专属折扣,客服老师微信:mede1219)
美联医邦海外医疗可协助您参与到美国视频会诊/赴美治疗,详情请阅读下方链接:
https://www.medebound.com/guide/1061
https://www.medebound.com/guide/1050
美国看病常见问题FAQ
美联医邦提供【病历翻译,医疗签证,医院预约】一条龙服务,为您省时省力,且预约效率更高,可对接到美国医院主任级别专家,费用仅需3万人民币, 请联系我们了解详情。
联系方式:
国内电话热线400-6162591,出国看病服务机构了解到 电话进来后请告知文章专属码1219获取专属折扣, 或加客服老师微信mede1219立即沟通。
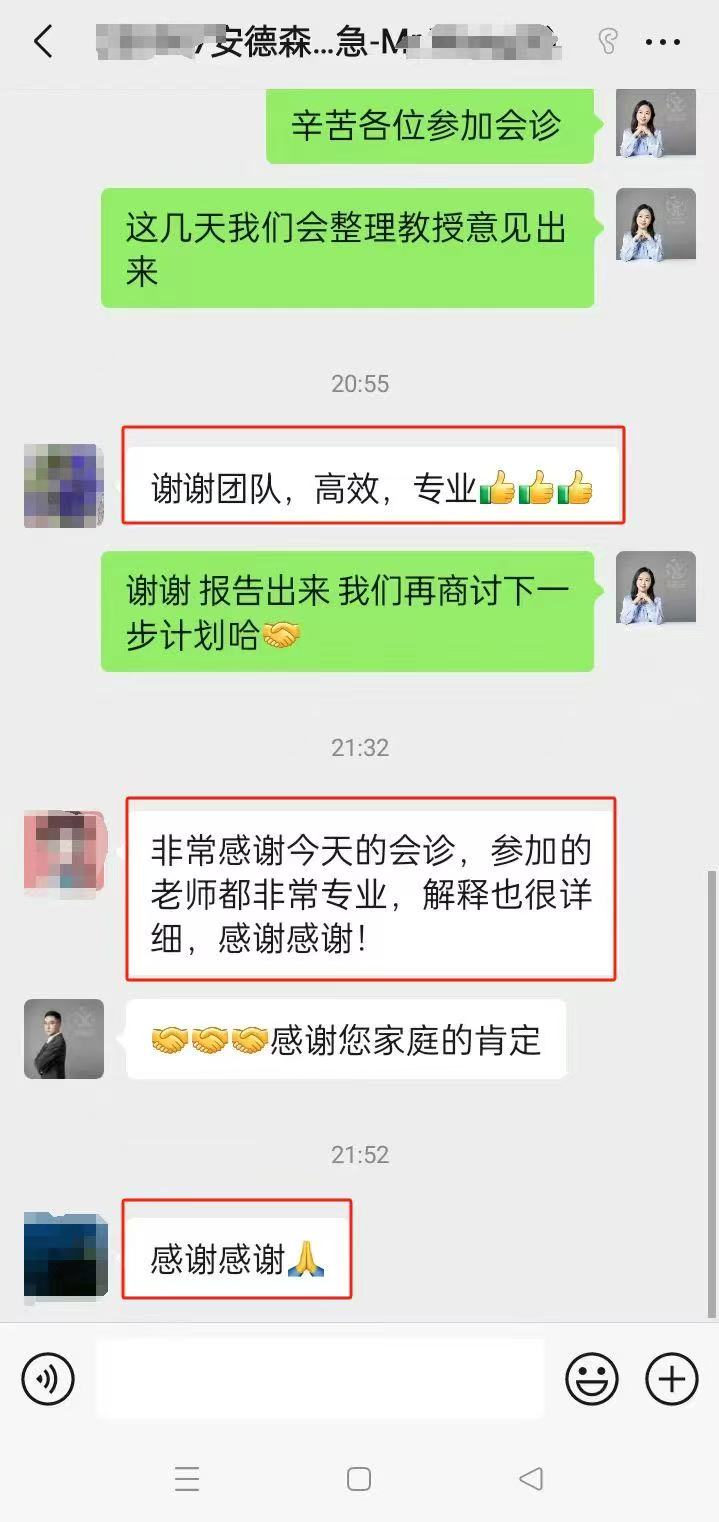
远程会诊|出国成功案例:
安德森会诊案例—晚期胰腺癌赴美安德森治疗为何仍需远程会诊?
赴美面诊美国儿科神经罕见病专家获取美国新药
赴美就医:2023年机构选择和费用
「 MD安德森癌症中心口腔癌治疗案例 」 「 MD安德森癌症中心黑色素瘤治疗案例 」 「 MD安德森癌症中心肺癌治疗案例 」 「 MD安德森癌症中心鼻咽治疗案例 」 「 MD安德森癌症中心肠癌肝癌治疗案例 」
免责声明:本文无意影响或改变您的主治医生提供的医疗服务。 请不要在没有先咨询您的主治医疗服务提供者的情况下对您的治疗做出改变。 本文不用于诊断或治疗疾病,出国看病服务机构了解到也不影响治疗方案。 美联医邦会尽最大努力编辑和更新本页面的信息,但是我们无法保证本页医药信息的精确性和完整性。
本文由美国美联医邦Medebound编辑原创,未经美联医邦允许,不得转载,违者必究。 美国美联医邦借助其30年历史的美国顶级名医网络,用便捷通道帮助国内患者接触到世界先进治疗方法,开展美国肿瘤罕见病名医视频咨询,出国就医和新药绿通,为生命续航。 电话:4006162591,微信公众号:搜索“美联医邦”。
美国美联医邦Medebound HEALTH 是一家创始在美国,总部位于纽约,并在大陆和香港设有分部的国际医疗公司。 董事会由资深的美国医院领导组成。 纽约医学院前院长克鲁力博士担任美联医邦董事和秘书长; 纽约五所医院包括纽约最大医院长老会医院董事卡思先生担任美联医邦董事; 哈佛大学医学院教授,飞利浦全球家庭医疗前首席医疗官维特博士 担任美联医邦独立董事。 我们致力于帮助世界有疑难重疾患者对接到美国顶级医疗资源,专注于开展美国肿瘤罕见病名医的第二诊疗意见,视频咨询,出国就医和美国最新药物申请。 至今美联医邦已经签约中国保险集团总部包括中国平安,泰康,太平人寿等,服务覆盖数百万保险人群。










 美联医邦
美联医邦